AMLにおけるKITシグナルの局在を特定し、阻害戦術の可能性を探索
東京理科大学は9月19日、急性骨髄性白血病(AML)がKIT変異体を持つ場合には、増殖シグナルが、今まで考えられてきた細胞膜からではなく、ゴルジ体から発信されていることを見出したと発表した。この研究は、同大研究推進機構総合研究院客員准教授(兼)国立がん研究センター研究所の小幡裕希ユニット長、同大学理学部第一部応用化学科の椎名勇教授、帝京大学戦略的イノベーション研究センターの安部良特任教授が、国立がん研究センター中央病院西田俊朗中央病院長、国立がん研究センター研究所岡本康司分野長と共同で行ったもの。研究成果は「Cell Communication & Signaling」に掲載されている。
画像はリリースより
AMLは、血液系の前駆細胞が制御不能な増殖をするがんであり、それにより、正常な造血機能が障害される。日本では、1年間に3,000~4,000人が発症し、標準的な化学療法により、多くの患者で寛解あるいは5年無再発生存が得られているが、AML細胞がFLT3やKITのようなチロシンキナーゼの遺伝子に変異を持つと、予後が悪いことが報告されている。AMLにおいて、FLT3変異は約30%の症例で認められ、そのチロシンキナーゼ活性に対する分子標的治療薬が開発されてきた。
研究グループは、これまでに、KIT変異が原因のがんに着目して研究を進めており、マスト細胞腫やGISTの変異型KITが細胞内小器官で増殖シグナルを発信していることを見出していた。さらに、椎名教授が全合成に成功したタンパク質輸送ブロッカーのM-COPA(2-メチルコプロフィリンアミド)が、KITのシグナルの場(ゴルジ体)への移行阻害を介して、マスト細胞腫・GISTの無限増殖を抑制することを報告している。そこで、今回の研究では、AMLでのKITがどこに局在して増殖シグナルを発信しているのか、M-COPAがKITシグナルをブロックして無限増殖を抑制できるのかについて検討し、AMLにおけるKITシグナルの阻害戦術の可能性を探索した。
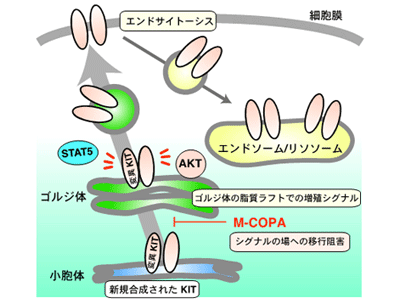
AMLの変異型KITシグナルはゴルジ体から発信、脂質ラフト領域が重要
研究では、患者から樹立された複数のAML細胞株を用い、KIT変異体の細胞内局在の蛍光イメージング、生化学的解析、増殖シグナルに対するM-COPAの阻害効果の検討を試みた。非AML細胞にみられる正常なKITは、細胞膜に分布しているが、AML細胞のKITの活性化変異体は、細胞膜ではなく、細胞内小器官(オルガネラ)に局在しており、正常KITとはシグナル伝達する場所が異なることが予想された。研究グループは、変異型KITが小胞体からゴルジ体、エンドソームの経路で移行していることを確認し、AMLのKITがそれらオルガネラに認められることを明らかにした。
さらに、KITの活性化を認識する抗体で蛍光イメージングを行うと、KITは核近傍のゴルジ体領域に限局して活性化していることが明らかになった。そこで、細胞内輸送ブロッカーのM-COPAでKITを小胞体に停留させ、ゴルジ体への移行を阻害したところ、KITが活性化できず、それに伴い、下流のAKT・ERK・STAT5といった増殖を担うシグナル伝達分子群の機能が抑制された。近年、ゴルジ体でのシグナル伝達には、「脂質ラフト」と呼ばれる微小領域が役割を果たすことが示唆されおり、AML細胞の正常な脂質ラフトの形成を阻害したところ、ゴルジ体でのKITシグナルが顕著に抑制された。
M-COPAの作用機序はイマチニブ抵抗性の克服につながる可能性
今回の研究成果は、AMLの変異型KITのシグナルにおけるゴルジ体の脂質ラフト領域の重要性を示唆するもの。また、M-COPAは、変異型KITを小胞体に留め、シグナルの場であるゴルジ体への移行を阻害することで、AML細胞の増殖を抑制することが示された。AMLで認められるKITの活性化変異体には、既存の分子標的治療薬であるKITキナーゼ阻害剤イマチニブが効きづらいことが報告されており、M-COPAの作用機序は、イマチニブ抵抗性の克服につながることが示唆される。
今後、研究グループは、FLT3変異体が細胞内小器官に停留してシグナルを発信しているのか、それがどのような分子機構で起きるのか、細胞内輸送のブロッカーが増殖シグナルに対する新たな阻害戦術となるかを検討する予定。他のがんの変異シグナル分子でも、KITと似た細胞内停留・シグナルのメカニズムを見出しており、今後、臨床検体での解析や、実験動物におけるM-COPAの阻害効果の検討を計画している。
▼関連リンク
・東京理科大学 プレスリリース




