若者で発生し高齢者では少ない明細胞肉腫(CCS)に着目
東京大学医科学研究所は9月9日、細胞老化による発がん抑制メカニズムを明らかにし、その分子基盤を標的とする新たながん治療法開発の可能性を見出したと発表した。この研究は、京都大学iPS細胞研究所(現・岐阜大学医学部整形外科)の河村真吾助教、東京大学医科学研究所の伊藤謙治特任研究員、山田泰広教授らの研究グループによるもの。研究成果は、「Nature Communications」に掲載されている。
画像はリリースより
発がんの原因のひとつとして遺伝子変異が知られており、また、細胞・組織ごとに異なるエピゲノムも発がんにおいて重要であることが示唆されている。近年、個体の老化に関与している細胞老化が、発がんの抑制機構として働いていることがわかってきた。今回の研究では、若者に発生するが高齢者では少ない明細胞肉腫(Clear Cell Sarcoma:CCS)に着目し、発がんにおけるエピゲノム制御の重要性と細胞老化の役割を個体レベルで解明することを目指した。
エンハンサー領域のエピゲノムの違いが細胞老化誘導・腫瘍形成の違いの原因に
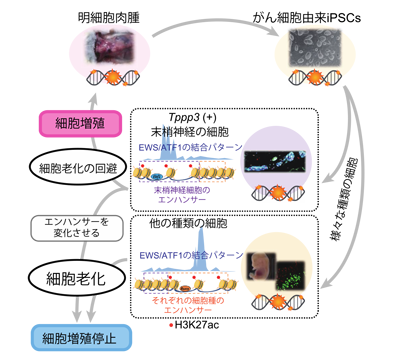
研究グループは、これまでにCCSのマウスモデルに形成される腫瘍からCCSの細胞株を樹立していた。今回の研究では、このがん細胞株からiPS細胞(CCS-iPSCs)を樹立して研究に用いた。CCS-iPSCsをマウスの胚盤胞に移植することで、CCSの遺伝子変異を持ち、かつ薬剤依存的にCCSのドライバーとなる融合遺伝子(EWS/ATF1融合遺伝子)の発現を誘導することが可能な細胞を全身に持つキメラマウスの作製に成功。このキメラマウスに薬剤を飲ませてEWS/ATF1融合遺伝子の発現を再誘導したところ、全身のさまざまな組織でEWS/ATF1を発現しているにもかかわらず、皮下組織でしか腫瘍が形成されないことがわかった。このことから、発がんには遺伝子変異だけでなく、細胞・組織ごとに異なるエピゲノムも重要であることが示された。
次に、CCS-iPSCsを用いて作製したキメラマウスで発がん過程を詳細に解析。細胞老化を示すマーカーとして知られる遺伝子群(p21、p53)の発現に着目した。その結果、腫瘍が形成されなかった多くの組織では、これらの細胞老化に関連する遺伝子群が発現しており、さらに細胞増殖も停止していることから、細胞老化が起きていることが明らかになった。一方で、腫瘍が形成された皮下組織では細胞老化の回避が起こり、速やかに活発な細胞増殖が誘導されることが示された。
続いて、CCSと同じ遺伝子変異をもつキメラマウス胎児由来の線維芽細胞を用いて、大規模なエピゲノム解析を実施。その結果、線維芽細胞では遺伝子発現に重要な役割をもつエンハンサー領域が元々のがん細胞であるCCSとは大きく異なることがわかった。さらに、CCSの細胞株で認められる特定のエンハンサー領域を人為的に変化させることで、がん細胞であるCCSに細胞老化が誘導され、細胞増殖が抑制できることが明らかになった。
同研究では、発がん抑制における細胞老化の重要性を個体レベルで明らかにした。また、細胞・組織ごとに異なるエピゲノム、特にエンハンサー領域の違いが、細胞老化誘導の違い、腫瘍形成の違いの原因となっていることがわかった。がん細胞で認められるエンハンサー領域を人為的に変化させることで、がん細胞に細胞老化を誘導し、細胞増殖を抑制することを示した。研究グループは、がん細胞のエピゲノムを標的とすることで細胞老化の仕組みを利用したがんの制御法の開発に貢献できる可能性が示された、と述べている。
▼関連リンク
・東京大学医科学研究所 プレスリリース



