自己免疫疾患と自己炎症性疾患に分類できる、免疫が原因の炎症性疾患
京都大学は9月6日、リンパ球が炎症を引き起こす新たなメカニズムを明らかにしたと発表した。この研究は、同大大学院・医学研究科の佐々木克博講師、岩井一宏教授らの研究グループが、理化学研究所と共同で行ったもの。研究成果は、英国の国際学術誌「Nature Communications」にオンライン掲載されている。
画像はリリースより
免疫が引き起こす炎症性疾患は、リンパ球などを含む獲得免疫システムが原因となる「自己免疫疾患」と、自然免疫システムや炎症性サイトカインの過剰産生が原因となる「自己炎症性疾患」の大きく2つに分けられる。
Sharpin遺伝子を原因遺伝子とする突然変異マウスcpdmは、重篤な皮膚炎を発症することが知られている。SharpinはHOIP、HOIL-1Lと呼ばれるタンパク質とともに複合体型酵素LUBACを形成して直鎖状ユビキチン鎖を生成することで細胞などの活性化、細胞死の抑制に寄与するタンパク質。cpdmはSharpinが欠損しているために、LUBACが著減し、皮膚炎を発症する。これまで皮膚炎の発症は、TNFαなどのサイトカインによって皮膚を構成する細胞(特に表皮細胞)の細胞死が亢進することが原因とされており、また、病巣部にリンパ球の存在や自己免疫疾患の特徴の1つである自己抗体が認められないことなどから、自己炎症性の皮膚炎であると考えられてきた。
一方で研究グループは、詳細な解析からcpdmマウスでは、T細胞を中心とした獲得免疫システムにも異常があることを見出しており、自己免疫性の炎症メカニズムも発症している可能性が想定された。
自己炎症性疾患群の発症要因にT細胞が関与している可能性
今回の研究は、cpdmの皮膚炎が、自己免疫疾患と自己炎症性疾患という2つの異なる要因から形成されているのかという疑問点を解決するために行われたもの。
cpdmの皮膚炎は、皮膚表皮細胞(ケラチノサイト)の細胞死の亢進がその主因であると考えられていたため、皮膚表皮細胞のみでSharpinを欠損させたマウス(Sharpin Skin-KO)を作成。すると、cpdmと同様の表皮細胞の細胞死と、それに基づく慢性皮膚炎を発症したことから、従来考えられていたように、cpdmの皮膚炎は自己炎症性である可能性が示唆された。
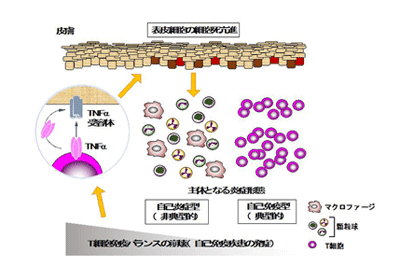
さらにT細胞の関与を明らかにするため、T細胞だけでSharpinを欠損するマウスを作成したところ、ほとんどのマウスは正常だったが、約10%は皮膚炎を発症した。T細胞は炎症を誘導するタイプと抑制するタイプの細胞に分けられ、免疫機能の恒常性を保つため、互いが常に機能的な均衡を維持する必要がある。そこで、炎症を抑制するタイプのT細胞である制御性T細胞のみでSharpinを欠損させたところ(Sharpin T-KO)、T細胞全てで欠損させた場合とは異なり、全てのマウスが皮膚炎を発症した。LUBACはT細胞の活性化にも関わるので、この結果はSharpinの欠損で制御性T細胞の機能が低下して免疫バランスの恒常性が崩れ、炎症を誘導するタイプのT細胞が活性化することが原因で皮膚炎が発症することを示している。つまり、cpdmでは、自己炎症性(皮膚の細胞死が主体となる炎症)と自己免疫性(T細胞が主体となる炎症)の2つの異なる機序が両方とも関わって皮膚炎を発症している可能性が考えられるという。
自己免疫疾患はリンパ球が炎症を起こすため、病巣にはリンパ球が浸潤している。しかし、制御性T細胞特異的なSharpin欠損マウスは、T細胞が主因で炎症が起きるにもかかわらず、皮膚にはリンパ球ではなく、cpdmや皮膚特異的Sharpin欠損マウスと同様に、マクロファージや好中球といった自然免疫系の細胞群が浸潤していた。加えて、アポトーシスおよびネクロプトーシスと呼ばれる複数の細胞死が表皮細胞で起きており、自己炎症性の病気と似た所見を示した。T細胞がcpdm由来の細胞の細胞死を誘導できることを培養実験系を樹立して調べたところ、TNFα標的薬で細胞死が抑制できることが判明。さらに、制御性T細胞特異的Sharpin欠損マウスの皮膚内では、わずかではあるが、TNFα陽性のT細胞(CD69+CD103+組織常在性記憶型)が特異的に存在していたので、このT細胞群がTNFαを介して表皮細胞の細胞死を誘導している可能性が強く示唆された。LUBACはアポトーシス、ネクロプトーシスと呼ばれる細胞死を抑制する。TNFαやネクロプトーシスの実行因子であるRIPK3の欠損マウスとSharpin T-KOを交配すると、Sharpin T-KOの皮膚炎の重症度が著しく抑えらた。
以上の結果から、Sharpin T-KOで誘導されるT細胞依存的な皮膚炎は、T細胞が発現しているTNFαによる表皮細胞の細胞死が引き金となって発症する自己炎症性疾患のような機序で生じる炎症であることが明らかとなった。LUBACは3つのタンパク質から構成されており、Sharpinを欠損すればLUBACの量は顕著に減少するが、もう1つの構成分子であるHOIPの量を半分にすれば、LUBACの量はさらに減少する。そこで、制御性T細胞の機能をさらに低下させて、炎症を誘導するタイプのT細胞をさらに活性化させる目的で、制御性T細胞特異的にSharpinを完全に消失し、HOIPが半分の量になったマウスを作成。そのマウスも皮膚炎を生じたが、炎症を起こしている主たる細胞はマクロファージや好中球ではなくリンパ球であり、自己免疫疾患と診断できる皮膚炎だった。しかし、同時に皮膚表皮細胞の細胞死も観察されたため、自己炎症と自己免疫の両方が混在している炎症であると考えられた。
T細胞が引き起こす炎症は自己免疫疾患と定義されるが、今回の発見は、T細胞は複数の経路で炎症を生じさせることができ、場合によっては自然免疫系の異常な活性化によって生じるような炎症も起こし得ること、その機序の1つはT細胞が惹起する細胞死誘導性であることを証明した。加えて、獲得免疫系の細胞であるT細胞が過剰に活性化されるだけで、自然免疫系をも活性化させ、自己免疫疾患を起こせることも明確にした。
病因が異なる疾患でも、見かけ上類似した様相を示す疾患が存在することを証明
これまで、リンパ球であるT細胞が自己を傷害する炎症は、病巣にリンパ球が浸潤する自己免疫疾患と考えられてきた。しかし今回の研究成果から、T細胞はリンパ球非依存性と考えられる自己炎症性疾患と診断されるような自己を傷害する炎症にも関与する可能性が明らかになった。自己免疫疾患である慢性関節リウマチでは抗TNFα抗体が著効を示すが、それらの自己免疫疾患の病態形成に今回発見した経路が関与している可能性が高く示唆される。さらに、病因が明らかに異なる疾患であっても、見かけ上類似した様相を示す疾患が存在することを、実験的に明確に証明した。
研究グループは、「本研究結果に加えて、他の自己免疫疾患モデルや炎症モデルにおいて、見出した新規炎症メカニズムの存在を改めて解析することが今後の課題であると考えている」と、述べている。
▼関連リンク
・京都大学 研究成果



