パーキンソン病患者脳で蓄積している「アミロイド繊維」
量子科学技術研究開発機構は8月26日、脳内に存在する正常なタンパク質「α-シヌクレイン」の分子の特定の運動が、パーキンソン病発症のカギとなる「アミロイド線維」という異常な塊を作り出す原因となることを突き止めたと発表した。この研究は、量研量子生命科学領域の藤原悟専門業務員、松尾龍人主任研究員、河野史明研究員、名古屋大学シンクロトロン光研究センターの杉本泰伸准教授、構造生物学研究センターの成田哲博准教授、松本友治研究員、日本原子力研究開発機構J-PARCセンターの柴田薫常勤特別嘱託らが共同で行ったもの。研究成果は「Journal of Molecular Biology」に掲載されている。
画像はリリースより
パーキンソン病の患者の脳細胞には、α-シヌクレインという健常な脳内にも存在するタンパク質が、「アミロイド線維」と呼ばれる異常な線維状態となって蓄積していることが知られており、このアミロイド線維の形成がパーキンソン病発症のカギとされているが、未解明だった。
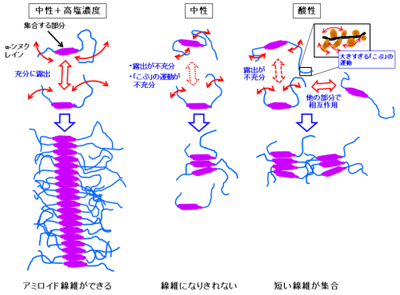
一方、タンパク質は、たくさんのアミノ酸が数珠つなぎにつながってできているが、その骨格である「ひも」からアミノ酸側鎖の「こぶ」がたくさん突き出ている。通常は、その「ひも」と「こぶ」がきちんと折り畳まれて特定の構造を形成し、本来の機能を発揮する。ところが、何らかの原因で、折り畳まれた構造の全体あるいは一部がほどけてしまい、「ひも」がグニャグニャになり、動きやすくなってしまうこと(変性)がある。また、この部分から突き出ている「こぶ」も、ふらふらと動きやすくなる。一般に、このタンパク質の「変性」がきっかけとなり線維の形成が始まるため、アミロイド線維形成の仕組みを明らかにするには、この「ひも」や「こぶ」の動きを詳細に調べることが重要とされている。研究グループは2016年に、アミロイド線維を形成した後の状態のα-シヌクレインの動きを調べ、線維状態ではタンパク質同士が強く結合して動きが制限されているにも関わらず、分子が局所的に大きく動くことを突き止めていた。
さまざまな認知症や難病の原因解明に期待
今回研究グループは、次のステップとして、線維が形成される過程について取り組んだ。α-シヌクレインは、どんな環境でもアミロイド線維を形成できるわけではなく、体内の環境に近い中性で生理的濃度に近い塩(高塩濃度)の入った溶液ではアミロイド線維を形成することができるが、中性でも塩が入っていなければ集合が足りず、線維になりきれないこと、また、酸性溶液中では線維が長くなる前に短い線維同士が急速に集合し、大きな塊を作ってしまうことが知られていた。同研究グループは、中性子準弾性散乱のデータと追加測定したX線小角散乱および動的光散乱のデータを組み合わせることで、タンパク質の「ひも」の折れ曲がり運動を調べる新しい解析法を開発。この方法で、解析を行ったところ、アミロイド線維を形成する過程では、α-シヌクレインの「こぶ」の局所的運動と「ひも」の折れ曲がり運動の両方が同時に活発でなければならないことが、中性子準弾性散乱によって世界で初めて観測された。
今回の研究の特色は、正常なタンパク質の「特定の運動」が、疾病発症の原因とされるアミロイド線維などの異常な構造ができる原因となることを示した点にある。これは、その運動を抑えることで異常な構造の形成を抑えることができる可能性を示すもの。今後、α-シヌクレインの分子の中のどの部分が曲がりやすいかなど、より詳しく運動を調べていくことで、「タンパク質の運動の制御」という全く新しい考え方に基づく創薬につながっていくことが期待される。
研究グループは、「アミロイド線維は、α-シヌクレインによるパーキンソン病に関係したもののみではなく、レビー小体型認知症やアルツハイマー病などのさまざまな認知症や家族性アミロイドポリニューロパチーをはじめとする種々の難病の発症に関係している。それぞれの疾病に関連するタンパク質について系統的に調べていくことで、アミロイド線維形成と疾病発症の根本的な関係の解明につながることが期待される」と、述べている。
▼関連リンク
・量子科学技術研究開発機構 プレスリリース



