100万人に1人の稀ながんで、原因不明だった「肝芽腫」
大阪大学は8月28日、小児の肝臓に発生する稀な悪性腫瘍である肝芽腫の原因となる遺伝子GREB1の同定に成功したと発表した。この研究は、同大大学院医学系研究科の松本真司助教と菊池章教授(分子病態生化学)らの研究グループによるもの。研究成果は、英科学誌「Nature Communications」のオンライン版に公開されている。
画像はリリースより
肝芽腫は小児の肝臓に発症する悪性腫瘍で、日本国内では年間30~40名、世界的には、100万人に1名程度の頻度で発生する稀な疾患。発生原因も明らかにされていなかった。腫瘍が大きくなるまでは無症状であることが多く、発見された時点では、腫瘍が大きすぎて手術が不可能なこともあり、すでに肺などに転移している場合は生存率が低下する。しかし、手術以外の化学療法では、重篤な副作用が問題となっている。そのため、副作用が少なく、良好な治療効果の得られる新規の分子標的治療薬の開発が待望されている。
原因となる遺伝子GREB1を同定、それを標的としたアンチセンス核酸も開発
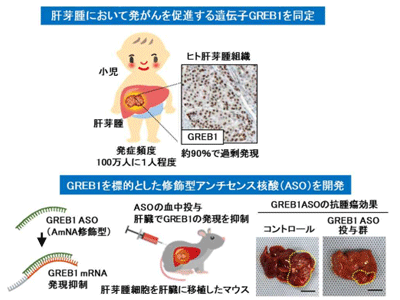
今回研究グループは、肝芽腫における新たな分子標的としてGREB1を同定。菊池教授らのグループは、肝芽腫において高頻度に異常活性化することが知られているWnt(ウィント)シグナルによって誘導される下流遺伝子を網羅的に探索してGREB1を同定し、肝芽腫の約90%の患者においてGREB1が過剰に発現することを見出した。GREB1を発現する肝芽腫細胞でGREB1の発現を抑えると、細胞の増殖が阻害され、細胞死が誘導された。また、GREB1は肝芽腫細胞の核内でTGFβシグナルの主要構成因子であるSmad2/3という細胞増殖の制御因子と結合して、その働きを抑えることにより、肝芽腫の増殖を促進する分子メカニズムを解明した。
さらに、肝芽腫の治療開発を目的として、細胞内タンパク質であるGREB1の発現を抑制するための修飾型アンチセンス核酸を大阪大学大学院薬学研究科生物有機化学分野との共同研究で新たに開発。肝芽腫細胞を移植したマウスに開発したアンチセンス核酸を投与したところ、GREB1の発現と腫瘍形成を抑制する効果があることがわかったという。
今回の研究成果により、遺伝子変異による高頻度なWntシグナルの異常活性化がGREB1の発現を介して、肝芽腫の形成を促進する分子メカニズムが初めて解明された。また、開発したGREB1に対する修飾型アンチセンス核酸が肝芽腫の形成を阻害する効果を有していたことから、今回の発見は、肝芽腫の新たな分子標的治療薬の開発に貢献することが期待される。
▼関連リンク
・大阪大学 研究情報



