ゲノム編集技術で遺伝子ファミリーを解析
大阪大学は8月27日、ゲノム編集技術により、雄の生殖器官で発現する遺伝子ファミリーが精子の受精能力に必須であることを世界で初めて明らかにしたと発表した。この研究は、同大微生物病研究所の藤原祥高招へい准教授(現在:国立循環器病研究センター室長)、野田大地助教、伊川正人教授らと、ベイラー医科大学のMartin M. Matzuk教授らの研究グループによるもの。研究成果は、米国科学アカデミー紀要(PNAS)電子版に掲載された。
画像はリリースより
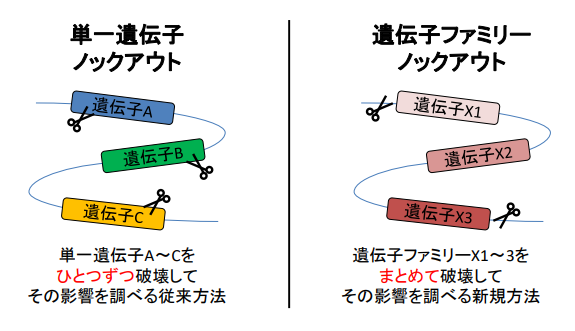
研究グループはこれまでに、ゲノム編集技術CRISPR/Cas9(クリスパーキャスナイン)を駆使して迅速かつ高効率に遺伝子ノックアウトマウスを作製し、雄に特異的に発現する遺伝子93個が生殖能力に必須ではないことを明らかにしていた。これらの報告は単一遺伝子を対象とした研究で、遺伝子ファミリーを対象とした個体レベルでの機能解析はあまり進んでいなかった。ひとつの遺伝子を破壊しても他のファミリー遺伝子が機能補償することで表現型が現れない(隠れてしまう)ケースが多くあったため、雄特異的な発現を示す遺伝子ファミリーに着目した研究が行われた。
子宮から卵管への移行に関連する遺伝子群を同定
研究グループは、ゲノム編集技術CRISPR/Cas9の利点を活用し、染色体上でクラスターを形成する遺伝子ファミリーについて、クラスターごと欠損させたモデルマウスを作製。蛍光精子を用いた観察から、野生型マウス精子と比較して、欠損マウス精子は、子宮から卵管への移行不全を起こしているとわかった。これにより、精子の受精能力を制御している遺伝子ファミリーの同定に成功した。
日本では、約6組に1組の夫婦が不妊の検査や治療を受けており、不妊症は社会問題のひとつになっている。今回同定した遺伝子ファミリーは今後、男性不妊の新たな原因遺伝子として検査・診断の対象となり、治療の確立や応用につながるものとして、期待が寄せられる。
▼関連リンク
・大阪大学 研究情報



