生体膜内葉のPSが外葉に露出して生体反応が起こる
東京大学は8月19日、ヒトが持つP4-ATPaseとCDC50の複合体の立体構造を、クライオ電子顕微鏡を用いた単粒子解析法によって明らかにし、P4-ATPaseがATPを利用してリン脂質を輸送する過程の複数の状態の立体構造を明らかにすることで、リン脂質の輸送機構を解明することに成功したと発表した。この研究は、同大大学院理学系研究科生物科学専攻の平泉将浩社会人博士課程(田辺三菱製薬株式会社創薬本部創薬基盤研究所研究員)、山下恵太郎助教、西澤知宏助教、濡木理教授らの研究グループによるもの。研究成果は8月16日に、「Science」のFirst Release版でオンライン公開された。
画像はリリースより
真核細胞の生体膜はリン脂質二重層によって形成され、細胞外側の層(外葉)と細胞質側の層(内葉)で異なるリン脂質が分布することで、さまざまな生体反応に関与している。たとえば、ホスファチジルセリン(PS)の多くが内葉側に存在するが、この非対称性が崩れてPSが外葉側に露出することでシグナル伝達や免疫応答を引き起こす。
P4-ATPase遺伝子変異でPS非対称分布が崩れると疾患に
PSが外葉に存在すると過剰な応答を起こすため、PSを内葉側に局在させるための仕組みが存在する。P型ATPaseの1つであるP4-ATPaseはPSの非対称分布の維持に関わるフリッパーゼとしてはたらくと知られている。ヒトは14種のP4-ATPaseを保持し、多くはアクセサリータンパク質であるCDC50ファミリーと複合体を形成することで、適切な組織で発現してフリッパーゼ活性を持つ。P4-ATPaseのうち最初に同定されたATP8A1は、PSを特異的に外葉から内葉へ輸送することでその生体膜の非対称性を維持しており、ATP8A1ノックアウトマウスは海馬ニューロン細胞膜の外葉におけるPSの露出が亢進して、海馬依存性の学習障害を示す。また、その類似タンパク質であるATP8A2の遺伝子変異は神経系疾患であるCAMRQを引き起こし、ATP8B1の遺伝子変異はBRIC1およびPFIC1として知られる代謝性疾患を引き起こすことが知られている。
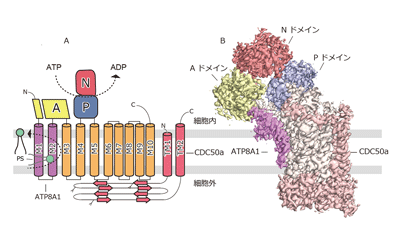
P型ATPaseはこれまでに、筋小胞体Ca2+ポンプ(SERCA)やNa+/K+‐ATPaseなどの金属イオンを基質として輸送するP2-ATPaseのメカニズムに関しては詳細に研究されてきたが、P4-ATPaseのように非常に大きな分子であるリン脂質を輸送する仕組みは不明なままだった。そこで今回、研究グループは、クライオ電子顕微鏡を用いた単粒子解析法を用いて、ヒト由来のATP8A1-CDC50aの立体構造を原子分解能で決定した。
リン酸が完全に外れることで疎水性ゲートが開きPS輸送
得られた立体構造から、ATP8A1はP型ATPase構造を示し、3つの大きな細胞質ドメイン(A:アクチュエータドメイン、N:ヌクレオチド結合ドメイン、P:リン酸化ドメイン)と10本の膜貫通ヘリックス(M1~10)から構成されることが判明。一方、CDC50aはN末端とC末端に2つの膜貫通ヘリックス(TM1およびTM2)を持ち、ATP8A1と細胞外・膜貫通・細胞内領域を介して強固な複合体を形成していた。
さらに、P4-ATPaseは、ATPaseドメインがATP加水分解に共役したリン酸化と脱リン酸化による構造変化を伴うことでリン脂質を輸送すると考えられていたが、ATP結合状態を模倣するATPアナログ(AMPPCP)、リン酸化状態を模倣するアルミニウムフロライド(AlF4-)やベリリウムフロライド(BeF3-)を用いて、リン脂質輸送における異なる中間体の立体構造を明らかにすることで、リン脂質の輸送機構を解明することに成功した。具体的には、リン酸化された状態では、基質であるリン脂質が結合しやすい状態になっており、Aドメインが約22°回転することで膜貫通ヘリックス(M1、M2、M4、M6)が親水的な溝を形成し、そこにPSの親水性部位が結合することがわかった。結合したPSは疎水性ゲートによって細胞外側に留められた状態だったが、リン酸が完全に外れることで疎水性ゲートが開き、PSは外葉から内葉へと輸送されることが示唆された。「このようなリン脂質の輸送は、新規な機構であり、P4-ATPaseの変異が原因となる疾患のさらなる理解につながると期待される」と、研究グループは述べている。
▼関連リンク
・東京大学大学院理学系研究科・理学部 プレスリリース



