ARF6-AMAP1経路を活性化する2つの変異との関連を検証
北海道大学は8月13日、膵がんの悪性度進展とがん免疫回避に関する分子メカニズムの解明に成功したと発表した。この研究は、同大大学院医学研究院分子生物学教室の佐邊壽孝教授、消化器外科学教室Ⅱの平野聡教授らの研究グループによるもの。研究成果は、米国科学アカデミー紀要(PNAS)に掲載されている。
画像はリリースより
がん免疫療法は大きな脚光を浴びているが、その適用範囲や効果はまだ限定的。膵がんは、見つかった時点ではすでに局所浸潤や転移を起こしていることが多く、抗がん剤抵抗性も高く予後不良だ。5年生存率は10%以下の難治性がんとされる。膵がんの多くは膵管上皮に由来し、これまでの動物実験から膵がんのドライバー遺伝子KRAS変異とTP53変異とによって膵管がんの浸潤転移が起こると示唆されているが、その分子実態は明らかにはなっていない。
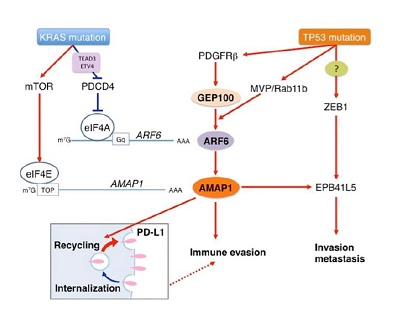
研究グループはこれまでに、タンパク質ARF6を基軸とする経路(ARF6-AMAP1)が乳がんなどさまざまながんにおいて悪性度進展に関与していることを見出している。さらに、乳がんにおいて、TP53 変異がメバロン酸代謝経路を介してARF6-AMAP1 経路を活性化し、これにより乳がんの悪性度進展に関与していることを見出している。今回の研究では、ARF6-AMAP1経路がKRAS変異とTP53変異を有する膵がんの悪性度にも関与していると考え、その仮説の検証とメカニズムの解明を行った。
KRASとTP53変異の同時発生が、がんの免疫回避に関与
研究ではまず、ヒト膵がん細胞株および膵がんモデルマウス由来の細胞を用いて、ARF6-AMAP1 経路因子の発現および浸潤転移性の解析、ヒト膵がん組織を用いた組織染色による予後との関連について解析を行った。また、ヒト膵がん細胞株 MIAPaCa-2を用いたショ糖密度勾配遠心法による分画を用いたin vitroトランスレーションによるタンパク質翻訳の評価と、TCGA(The Cancer Genome Atlas)と RNA-seq.解析による ARF6 発現に関わる転写因子の同定を行った。さらに、MIAPaCa-2 細胞を用いて IFN刺激を行い免疫チェックポイント分子PD-L1の発現を誘導し、PD-L1の細胞内動態およびリサイクリングを解析した。動物実験では、膵がんモデルマウス由来の膵がん細胞をマウスの皮下に移植し、腫瘍増殖能を解析することにより免疫回避との関連について調べた。
結果、ヒト膵がん細胞株および膵がんモデルマウス由来の細胞においてARF6-AMAP1 経路因子が高発現し、浸潤転移性等、膵がんの悪性度に関与していることを確認。病理標本解析からも、ARF6-AMAP1経路因子群の高発現により膵がん悪性予後因子となるとわかった。また、ARF6-AMAP1 経路因子と膵がんの悪性度に関する分子メカニズムを解析した結果、KRAS 変異と TP53 変異が協調してARF6-AMAP1経路の発現を高くさせ活性化することを見出した。その際、KRAS変異は翻訳開始因子eIF4Aが依存的にARF6の発現に関与していること、翻訳開始因子eIF4Eが依存的にAMAP1の発現に関与していることも判明。さらに、膵がんにおいてもTP53 変異はメバロン酸代謝経路を介してARF6経路を活性化すること、免疫逃避に関わる免疫チェックポイント分子PD-L1動態にもARF6経路の活性化が深く関与していることを明らかにした。
今回の研究により、KRASとTP53の変異が同時に起こることががんの免疫回避に大きく関与することと、ARF6経路の活性化には特定の代謝活性が必須であることが明らかとなった。また、この代謝経路をはじめ、いくつかの異なった分子標的の阻害により、がん細胞の免疫回避能を著しく低下させることが可能であることも実験的に立証された。「今回の研究成果は、ARF6-AMAP1経路が膵がんの免疫チェックポイント阻害による治療法のバイオマーカーになる可能性を示唆。膵がんだけでなく、多くのがんに対する免疫治療改善に大きく貢献するものだ」と、研究グループは述べている。
▼関連リンク
・北海道大学 プレスリリース



