「miR-Cas9スイッチ」を、より標的細胞特異的に改良
京都大学iPS細胞研究所(CiRA)は7月23日、マイクロRNA(miRNA)依存的に標的細胞ゲノムの編集を誘導する技術を開発したと発表した。この研究は、CiRA未来生命科学開拓部門の弘澤萌研究員、齊藤博英教授らの研究グループによるもの。研究成果は、米国科学誌「ACS Synthetic Biology」でオンライン公開されている。
画像はリリースより
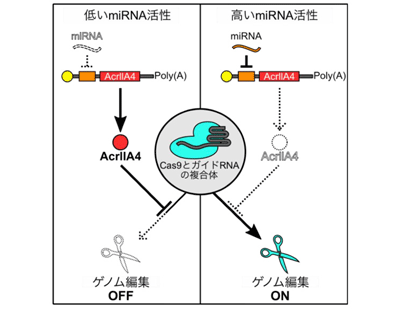
近年注目されているゲノム編集技術のひとつにCRISPR-Casシステムがある。以前、研究グループは細胞特異的にゲノム編集を行うために「miR-Cas9スイッチ」を開発。しかしこのシステムは、miRNAの活性が高いときにゲノム編集を起こらなくするもので、標的細胞を特異的に識別するために適したmiRNAを探すことが煩雑だった。またRNAからなる人工回路を用いることで、miRNAの活性が高い時にゲノムの編集を引き起こすことにも成功したが、標的以外の細胞においてもCas9の活性がみられることがあった。つまり、非標的細胞においてもゲノムが編集される可能性があった。そこで研究グループは、近年発見された、Cas9の機能を阻害する、抗CRISPRタンパク質の1つ「AcrllA4」に着目。このAcrllA4をmiRNAにより制御することで、miRNAの活性が高い時にのみゲノム編集を誘導できると考えられた。
miR-AcrllA4スイッチで、特異的ゲノム編集に成功
研究グループはまず、AcrllA4を作る配列を含むmRNAの5’非翻訳領域(5′-UTR)に特定のmiRNAを認識する配列を組み込み、miR-AcrllA4スイッチと名付けた。理論的には、このスイッチをmiRNAの活性が低い細胞に導入すると、AcrllA4が作られ、Cas9とガイドRNAの複合体に結合してゲノムの編集ができなくなる。一方、miRNAの活性が高い細胞では、miRNAがそれを認識する配列と結合することにより、AcrllA4の合成が抑制され、AcrllA4が作られない。そのため、Cas9が機能してゲノム編集が行われる。つまり、特定のmiRNAの活性が低い非標的細胞ではゲノム編集が起きず(オフ)、miRNAの活性が高い標的細胞ではゲノム編集が起きる(オン)。
このスイッチでゲノム編集を標的細胞で制御できるかどうかを実験で調べるため、研究グループは、HeLa細胞で活性が高いmiRNA(miR-21)を検知するスイッチ(miR-21応答性AcrllA4スイッチ)、HeLa細胞では活性の低いmiRNA(miR-302a)を検知するスイッチ(miR-302a応答性AcrllA4スイッチ)、miRNAを感知する配列を持たない対照スイッチという3種類のスイッチを用意した。
まず、HeLa細胞にmiR-21応答性 AcrllA4スイッチもしくは対照スイッチを、また、miR-21を阻害したHeLa細胞にmiR-21応答性 AcrllA4スイッチを導入し、AcrllA4の産生量を調べた。その結果、miR-21応答性AcrllA4スイッチのみの導入においてAcrllA4の産生が抑制されており、それがHeLa細胞内のmiR-21の活性に依存するものであることが確認された。次に、緑色蛍光色素を作るEGFP遺伝子をゲノムに組み込んだHeLa細胞にmiR-21応答性 AcrllA4スイッチあるいは対照スイッチ、また、miR-21を阻害したHeLa細胞にmiR-21応答性 AcrllA4スイッチを導入し、72時間後にHeLa細胞の蛍光強度をフローサイトメトリーで計測。すると、miR-21応答性AcrllA4スイッチを導入したHeLa細胞では蛍光強度が低く、miR-21を阻害した上でmiR-21応答性AcrllA4スイッチを導入したHeLa細胞は高い蛍光強度を示した。すなわち、miR-21に依存して、EGFP遺伝子を切断するゲノム編集が誘導されていることがわかった。
また、HeLa細胞では本来活性の弱いmiR-302aを標的miRNAとしても実験を行った。具体的には、miR-302a応答性 AcrllA4応答性スイッチとmiR-302aの活性を模倣した人工miRNA(miR-302a mimic)を一緒にHeLa細胞に導入した。すると、miR-302a mimicと、miR-302a AcrllA4応答性スイッチの両者を導入したHeLa細胞では蛍光強度が低く(ゲノム編集オン)、対照スイッチのみ、あるいはmiR-302a応答性 AcrllA4スイッチのみでは高い蛍光強度を示した。これらの結果より、同スイッチを用いることで、細胞特異的に活性の高いmiRNAを感知して、ゲノム編集を誘導できることが示された。
より安全な遺伝子治療や創薬研究などへの応用に期待
最後に研究グループは、Cas9の切断活性をなくした変異体(dCas9)に転写活性化因子(VPR)を融合させたdCas9-VPRを用いることで、miRNAの活性の高い細胞において遺伝子発現の活性化を試みた。緑色蛍光色素を作るhmAG1遺伝子の発現がdCas9-VPRにより制御されるようにしたHeLa細胞に、miR-21応答性AcrllA4スイッチあるいは対照スイッチ、またmiR-21を阻害したHeLa細胞にmiR-21応答性 AcrllA4スイッチを導入した。すると、miR-21応答性 AcrllA4スイッチを導入したHeLa細胞では高い蛍光強度を示したが、対照スイッチを導入したHeLa細胞や、miR-21を阻害した上でmiR-21応答性 AcrllA4スイッチを導入したHeLa細胞では低い蛍光強度だった。この結果より同スイッチが、細胞種特異的に活性の高いmiRNAを感知し、遺伝子の切断だけでなく、遺伝子発現を誘導することも可能であることが示された。
今回の研究では、AcrllA4と細胞種により活性の異なるmiRNAを利用することで、標的miRNAの活性が高い細胞のゲノムを編集する技術が開発された。また、以前開発された「miR-Cas9スイッチ」にあった問題点を改善することにも成功した。「より安全な遺伝子治療や創薬研究などに役立てるとともに、細胞特異的な遺伝子機能解析などの基礎研究での利用も期待できる」と、研究グループは述べている。
▼関連リンク
・京都大学iPS細胞研究所(CiRA) ニュース



