細胞を保護するNrf2の活性をストレスセンサーKeap1が調節
東北大学は7月17日、ストレスセンサーKeap1が酸化ストレスを感知する仕組みを解明したと発表した。この研究は、同大大学院医学系研究科の鈴木隆史講師(医化学分野)、山本雅之教授(医化学分野、東北メディカル・メガバンク機構 機構長)らの研究グループによるもの。研究成果は、米国科学雑誌「Cell Reports」のオンライン版に、7月16日付で公開された。
画像はリリースより
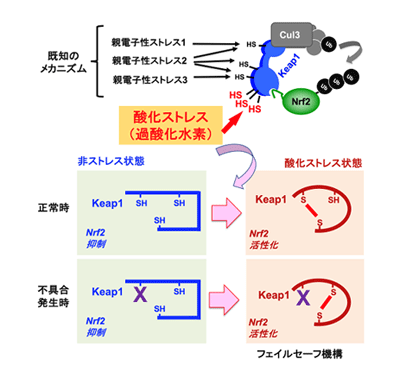
酸化ストレスは、老化、がんなどのさまざまな病気を引き起こす原因となるが、転写因子Nrf2は酸化ストレスに応答して活性化し細胞を保護する役割を担っている。Nrf2の活性は、ストレスセンサーKeap1によって調節されている。Keap1が環境中の毒物(親電子性ストレス)を感知する仕組みは、親電子性物質によるKeap1システイン残基の修飾であることが、すでに解明されていた。一方で、酸化ストレスがNrf2を活性化するメカニズムは長い間明らかにされていなかった。
Keap1は複数のシステイン残基を使い分けて酸化ストレスを感知
Keap1は、Cul3と複合体を形成してNrf2をユビキチン(Ub)化し、Nrf2を分解することでその働きを抑制する。今回の研究では、Keap1がこのメカニズムと異なる酸化ストレス感知メカニズムを持つことが明らかとなった。すなわち、酸化ストレスによって複数のシステイン残基の間でジスルフィド結合(SS結合)が形成されることによって酸化ストレスを感知し、Nrf2を活性化するというメカニズムである。
また、Keap1は、仮に不具合が発生した場合においても、酸化ストレスを感知して生体を守ることができる巧妙な仕組み(フェイルセーフ機構)を備えていることがわかった。具体的には、酸化ストレス感知に必要なシステイン残基の一部が親電子性ストレスなどによる修飾を受けてしまった場合でも、残ったシステイン残基の間でSS結合を形成することで、Nrf2活性化を引き起こすことを可能にするメカニズム。そのため、システイン残基を1つずつ失わせる従来の解析方法では明らかにすることは難しかったが、今回、複数のシステイン残基を同時に失わせる解析アプローチを採用したため、明らかにすることに成功した。この複数のシステイン残基の組み合わせは膨大であるため、これまで手付かずのままだった。
多くの基礎・臨床研究の成果から、Nrf2活性化は外部からの酸化ストレスを原因とした化学発がんなどさまざまな疾患の予防や治療に有効であることが明らかになっている。「今回の研究を進めていくことで、Keap1-Nrf2システムの活性化メカニズムの分子基盤の理解が進み、Keap1-Nrf2システムを利用した新薬や治療法の開発が加速することが期待される」と、研究グループは述べている。
▼関連リンク
・東北大学 プレスリリース



