世界の死因第4位のCOPD、病態解明は不十分
東京慈恵会医科大学は7月17日、喫煙によって有害な遊離鉄の産生が亢進し、肺上皮細胞の脂質酸化依存的な細胞死(フェロトーシス)につながることが、COPD(慢性閉塞性肺疾患)病態形成に深く関与することを明らかにしたと発表した。この研究は、同大呼吸器内科の桑野和善教授、皆川俊介講師、吉田昌弘大学院生及び北里大学薬学部の今井浩孝教授らの研究グループによるもの。研究成果は英科学誌「Nature communications」オンライン版に発表されている。
画像はリリースより
COPDは主に喫煙が原因である、慢性進行性の気管支閉塞と肺気腫を呈する難治性の疾患。2015年のWHOの調査では全死因の第4位だったが、今後第3位になると予測されており、医療経済的にも重要な疾患だ。タバコなどの煙を長期間吸い込むことで、咳、痰、呼吸困難を引き起こし、禁煙後も老化とともに進行する。現時点において気管支を拡張させて症状を和らげる薬はあるが、COPDの病態解明は十分になされておらず、予後を著明に改善させる有効な薬物療法の開発は遅れていた。
COPDに罹患した患者の肺(COPD肺)では、喫煙により肺の上皮細胞が傷害され、細胞死が起こっていることは報告されていたが、その機序は十分には解明されていなかった。
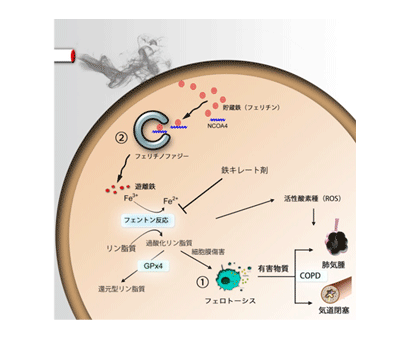
「フェリチノファジー」が起こり、肺上皮細胞が死んでいた
偶発的な細胞死ではなく、高度にプログラムされた計画的な細胞死の代表である「アポトーシス」は、これまでCOPDとの関連も報告されていた。近年新たな細胞死の形態として、鉄依存性の細胞死であるフェロトーシスが報告された。フェロトーシスは、細胞内の有害な遊離鉄によって細胞膜を構成する脂質が酸化反応を起こし、細胞死を引き起こすというもの。
今回研究グループは、COPD肺に鉄の過剰な蓄積が起こっていることに着目して研究を行い、フェロトーシスが喫煙によって誘導されることを証明した。また、細胞内の鉄は、フェリチンという安定、無害な状態で通常貯蔵されているが、オートファジー機構(細胞内タンパク質の分解機構)によって、有害な遊離鉄へと分解されることを明らかにした。このフェリチンを特異的に分解するオートファジーは「フェリチノファジー」と呼ばれ、NCOA4という積み荷タンパク質にフェリチンを乗せて、オートファジー機構へ運搬することが知られている。今回、肺上皮細胞においてNCOA4を不活性化すると細胞死が減少し、COPD形成を抑制する結果が示された。さらにフェロトーシス経路の核となる脂質の酸化反応を抑制するGPx4というタンパク質に着目し、このGPx4発現低下(不活性化)マウスおよび高発現マウスを用いて、タバコ喫煙暴露の実験を実施。GPx4高発現マウスでは、通常のマウスに比べてCOPDの病態形成が軽減され、GPx4発現低下マウスではCOPD病態が悪化した。
今回の研究により、これまで報告されていた機序とは全く異なるCOPD病態形成の新しいプロセスが、細胞レベルならびに分子レベルで明らかとなった。この結果を踏まえ、これまで根本的治療法のなかったCOPDに対する新たな予防法・治療薬の開発が進むものと期待される。
▼関連リンク
・慈恵大学 プレスリリース




