幹細胞から前駆細胞まで分化レベルの異なる細胞でDNA損傷応答を比較
東京工業大学は7月16日、iPS細胞から皮膚ケラチノサイトを作製し、皮膚における放射線の生体影響を明らかにしたと発表した。この研究は、同大学科学技術創成研究院 先導原子力研究所の島田幹男助教と松本義久准教授、大学院総合理工学研究科の三宅智子大学院生、科学技術創成研究院 未来産業技術研究所の沖野晃俊准教授らの研究グループが、タカラベルモント株式会社と共同で実施したもの。研究成果は米国放射線腫瘍学会誌「International Journal of Radiation Oncology Biology Physics」電子版に掲載されている。
画像はリリースより
生体では細胞内代謝により発生する活性酸素などの内的要因や紫外線、放射線などの外的要因により、常に細胞内DNAに損傷が生じている。その損傷は生体に本来備わっているDNA修復機構によって直ちに修復されるが、まれに修復し切れなかった損傷が細胞内に蓄積することにより、細胞のがん化や老化につながると考えられている。皮膚や筋肉、骨など身体を構成する体細胞の元になる幹細胞にDNA損傷が蓄積すると、細胞減少や細胞機能低下につながり、さまざまな老化現象を引き起こす。例えば、皮膚付属器官である毛包組織においてDNA損傷により幹細胞が枯渇すると白髪、薄毛などの老化現象に至る。
これまでヒト皮膚由来ケラチノサイトの放射線に対するDNA損傷応答に関する報告は少なかった。そこで今回の研究では、ヒトiPS細胞からケラチノサイトを作製し、幹細胞から前駆細胞まで分化レベルの異なる細胞のDNA損傷応答を比較。また、実際の皮膚に近い三次元細胞培養実験系を用いて放射線応答を解析した。
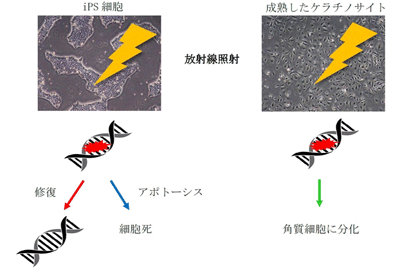
放射線で幹細胞は死にやすく、成熟するほど死ににくい
研究グループは、ヒト皮膚線維芽細胞から作製したiPS細胞を皮膚ケラチノサイトに分化誘導させ、線維芽細胞、iPS細胞、iPS細胞由来皮膚ケラチノサイトにおける放射線照射時のDNA損傷応答の違いを解析した。その結果、iPS細胞は線維芽細胞、ケラチノサイトに比べて、放射線に対する感受性が高く、死にやすい性質を持っていることが明らかになった。
DNA修復には多くのタンパク質が関与するが、クロマチン内のヒストンH2AXのリン酸化などを指標に解析を行った。その結果、iPS細胞ではリン酸化H2AXを持つ細胞が放射線照射8時間経過後も20%弱残っていたのに対し、継代1回後のケラチノサイトでは5%以下になっていた。皮膚ケラチノサイトは、継代を重ねるごとにDNA損傷修復速度に遅延がみられた。継代数が少ない細胞は幹細胞に近い性質を持っており、放射線照射により細胞生存率が低下し、プログラムされた細胞死であるアポトーシスの比率が増加したが、継代数の増加に伴い放射線に対して抵抗性を示すことがわかったという。
以上の結果より、未分化の細胞であるiPS細胞には、DNAが少しでも損傷したらアポトーシスによる細胞死を誘導するなど、DNA損傷が残存することを防ぐ機構が備わっていると考えられた。それに対して、成熟したケラチノサイトではDNA損傷が修復される速度と割合が減少していた。ケラチノサイトは成熟すると細胞核が消失し、角質層を形成し、物理的な刺激から体を守るという役割を担っている。つまり、いずれ核が消失する運命にあるために、成熟したケラチノサイトはDNA損傷を修復する機能が低下しても問題ないと考えられる。
同研究はiPS細胞から作製した皮膚ケラチノサイトにおける基礎的な放射線応答を解析した最初の例であり、がんや老化のメカニズム解明だけでなく、放射線治療における皮膚防護剤や皮膚疾患の治療薬、化粧品の開発などにも役立つことから、さまざまな分野への波及効果が期待される。
▼関連リンク
・東京工業大学 東工大ニュース




