胎生期膵臓形成に必須のPdx1、成体組織での働きは?
京都大学iPS細胞研究所(CiRA)は7月9日、胎生期膵臓形成に必須の遺伝子Pdx1が、成体膵外分泌細胞のミトコンドリア機能を維持し、細胞老化を阻害していることを見出したと発表した。この研究は、CiRA未来生命科学研究部門、京都大学医学研究科の堀口雅史客員研究生、吉田昌弘研究生および川口義弥教授らの研究グループによるもの。研究成果は、「FEBS Letters」で公開されている。
画像はリリースより
膵臓は、消化酵素を分泌する外分泌組織と、血糖調節を担うホルモンを血液中に放出する内分泌組織(膵島)の2種類の組織で構成され、外分泌組織が全体の約95%を占める。これまで転写因子Pdx1は、胎生期の膵臓形成において外分泌・内分泌組織両方の形成に必須で、成体になると内分泌インスリン産生細胞でインスリンやグルコキナーゼ、グルコーストランスポーター2などの血糖調節に重要な遺伝子群の発現調整をすることが知られていたが、成体外分泌組織でのPdx1の働きは、明らかにされていなかった。
Pdx1は成体膵外分泌細胞のミトコンドリア機能維持に必要
今回研究グループは、薬剤を用いて成体外分泌細胞だけでPdx1をノックアウトさせたマウス(Elastase-CreER;Pdx1cKOマウス)を用いた解析を行った。このマウスでは、薬剤投与量を調整することで、Pdx1をノックアウトする細胞量を調整することが可能。成体膵外分泌細胞の半分でPdx1をノックアウトしたところ、膵臓は肉眼的には全く異常を示さなかった。
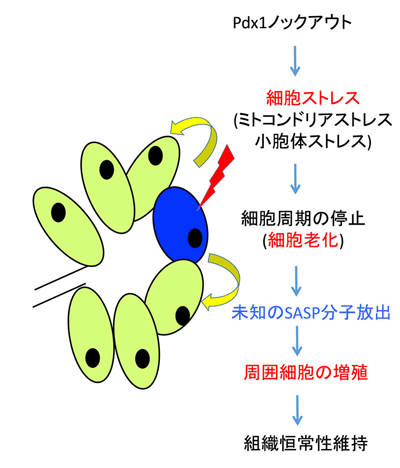
次に、Elastase-CreER;Pdx1cKO; ROSA-LacZマウスを用いて、Pdx1ノックアウトと細胞系譜解析法(Lineage tracing)の組み合わせを行った。このマウスでは、薬剤によってPdx1がノックアウトされた細胞を「X-Gal陽性」、薬剤の影響を受けずにPdx1が保たれた細胞を「X-Gal陰性」として、顕微鏡下で両者を区別して観察することが可能。成体膵外分泌細胞の半分でPdx1をノックアウトする条件で観察したところ、薬剤投与1か月後までは50%の細胞がX-Gal陽性だったが、3か月、6か月と経過していくうちに、X-Gal陽性細胞率が徐々に低下することを見出した。この間、膵臓サイズに大きな変化がなかったことから、Pdx1ノックアウト細胞が徐々に消失すると同時に、周囲の正常細胞の増殖も亢進することで、臓器恒常性が維持されていると考え、組織解析でそれを確認した。
さらに、このような緩徐な細胞入れ替わり現象の背景に潜む細胞機構を理解するため、観察を実施。まず、電子顕微鏡の観察から、Pdx1ノックアウトされた外分泌細胞では、ミトコンドリアストレスと小胞体ストレスが起こっていることがわかった。さらに、Pdx1ノックアウト細胞は、アポトーシスのような急激な細胞死を起こしているのではなく、細胞老化に陥っていることを発見。Elastase-CreER;Pdx1cKOマウスの膵臓では、免疫細胞が多く浸潤していることも判明し、老化細胞が免疫細胞によって徐々に除かれると考えられた。
今回の研究結果から、Pdx1ノックアウトにより引き起こされた細胞ストレスは細胞老化をきたし、自らは増殖周期を停止させてしまうが、それと同時に老化細胞は何らかのSASP分子を介して周囲の正常細胞の増殖を促し、臓器恒常性を保とうとしていることが考えられるという。
研究グループは、「これまで注目されてこなかった成体膵外分泌組織でのPdx1機能が明らかとなり、成体膵臓の機能的恒常性維持や臓器老化の理解が深まった。過去の研究で、胎生期膵臓形成においてPdx1と並んで必須の、もう一つの転写因子Ptf1aを成体でノックアウトすると、過大な小胞体ストレスを契機としたアポトーシスによって、膵臓が急激に小さくなることを見出しており、細胞除去の2通りの結末を、成体はどのようにして使い分けているのかが、今後の研究課題になる」と、述べている。
▼関連リンク
・京都大学iPS細胞研究所(CiRA) ニュース




