痛覚制御や血圧制御、薬物依存等に関与するNTSR1
東京大学は6月27日、多様な生理機能に関与する受容体膜タンパク質ニューロテンシン受容体(NTSR1)とGタンパク質の複合体構造を解明したと発表した。この研究は、同大学大学院総合文化研究科の加藤英明准教授とスタンフォード大学医学部分子細胞生理学科のBrian Kobilka 教授ら、Ron Dror教授、Georgios Skiniotis 教授のグループ、東北大学大学院薬学系研究科の井上飛鳥准教授のグループなどとの共同研究によるもの。研究成果は、「Nature」に6月26日付で掲載された。
画像はリリースより
NTSR1は、ホルモンや神経伝達物質として働く内在性ペプチド「ニューロテンシン」によって活性化される膜受容体タンパク質で、1~3型が存在している。そのうち、1型(NTSR1)と2型(NTSR2)はGタンパク質共役受容体(GPCR)に分類され、特にNTSR1は体内の血圧や体温、食欲や痛覚の制御を担う他、薬物依存やがん細胞の増殖制御にも関わっていることが報告されている。しかし、NTSR1の関わる生理機能が広範に渡るため、普通の作動薬や阻害剤は望んだ薬効以外の副作用を示してしまい、そのままでは薬として利用できていなかった。通常のGPCRは4種類存在するGタンパク質のうち1~2種類程度を選択的に活性化するが、NTSR1は4種類のGタンパク質全てを活性化するという特徴を有しており、このことが、NTSR1が多様な生理機能に関与する理由のひとつと考えられる。しかし、なぜNTSR1がそれだけ多くのGタンパク質を活性化できるのかということはもとより、NTSR1によるGタンパク質活性化の分子機構は、いずれのGタンパク質についてもほとんどわかっていなかった。
NTSR1によるGタンパク質活性化の際の構造体変化を解明
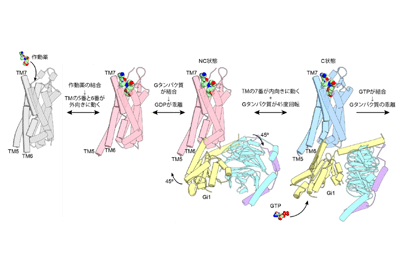
今回研究グループは、クライオ電子顕微鏡を用いた単粒子解析法を利用してヒト由来のNTSR1とGi1タンパク質の立体構造を原子分解能で決定した。決定されたNTSR1-Gi1複合体は溶液中で2状態(C状態、NC状態)の構造を取っており、そのうちNC状態の構造は、C状態と比較してGタンパク質が45度回転するという非常に大きな構造変化を示していた。これは他のGPCR-Gタンパク質複合体において報告されたことのない全く新規の構造だった
また、C状態のNTSR1が、活性化状態のGPCRに見られる(1)膜貫通ヘリックス(TM)の5番と6番が外向きに倒れる、(2)TMの7番が内向きに動く、という2つの構造的特徴を示していたのに対し、NC状態のNTSR1は外向きに倒れたTMの5番、6番を持つ反面、TMの7番が内向きに動いて「いない」という、活性化状態に見られる特徴と不活性化状態に見られる特徴を同時に有した構造をとっていた。そこで、分子動力学シミュレーションを行ったところ、C状態のNTSR1はNC状態を経て不活性化状態に構造遷移することが判明したため、NC状態の構造はGタンパク質がNTSR1によって活性化される際に形成する中間体状態であることが強く示唆された。
さらに、NC状態においてのみGi1タンパク質と相互作用しているNTSR1のアミノ酸残基に着目し、変異体解析を行ったところ、同アミノ酸残基の変異体は数あるGタンパク質の中でもGi/oファミリータンパク質の活性化効率のみを低下させることが判明した。このことから、NC状態は確かに生理的に重要な中間体状態であるとともに、とりわけGi/oファミリータンパク質との複合体形成においてのみ形成される特異的中間体であることが強く示唆された。
副作用を軽減させた鎮痛剤や降圧剤などの開発に期待
以上のような多面的な解析により、(1)NTSR1の作動薬がNTSR1に結合すると、まず(2)TMの5番と6番が外側に倒れ、(3)Gタンパク質がNTSR1に結合し(=NC状態)、(4)TMの7番が内向きに動くのと同時にGタンパク質が大きく回転し(5)完全な活性化状態(=C状態)に遷移する、という、NTSR1による段階的なGiタンパク質の活性化機構を提唱した。
今回の研究によって、NTSR1、ひいてはGPCRによるGンパク質活性化の分子機構に対する更なる理解が進むことが期待される。また、特定のGタンパク質に特有な中間体構造の形成を阻害、あるいは促進する化合物をデザインすることで、今後、特定のGタンパク質シグナルのみを制御する手法が確立できる可能性が考えられる。これが実現すれば、「副作用を軽減し望んだ薬効のみを最大限引き出す薬剤候補化合物の開発にもつながりうることが期待される」と、研究グループは述べている。
▼関連リンク
・東京大学 大学院総合文化研究科・教養学部 ニュース




