MeHgの低濃度曝露が心不全の病態を悪化させる分子機構
九州大学は6月26日、環境化学物質のひとつであるメチル水銀(MeHg)の低濃度曝露が心不全の病態を悪化させる分子機構を明らかにしたと発表した。この研究は、同大学院薬学研究院の西田基宏教授(自然科学研究機構生理学研究所(生命創成探究センター)兼任)と西村明幸講師が、筑波大学、東北大学、国立医薬品食品衛生研究所と共同で行ったもの。研究成果は「Science Signaling」に掲載されている。
画像はリリースより
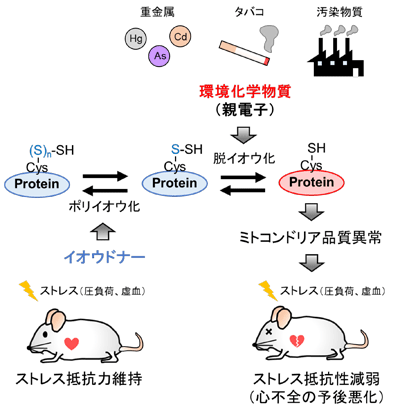
疾患が起きる原因には、遺伝的要因と環境要因があり、疫学調査の結果から、環境要因が疾患の原因の90%を占めることが示唆されている。また、日々の生活の中で多くさらされている環境化学物質の蓄積が、疾患発症リスクを高める原因になると考えられている。マグロやクジラ、カジキなどに含まれる微量の有機水銀も環境危険因子の一つであり、有機水銀の過剰摂取・体内蓄積が疾患リスクを高める原因となる可能性が指摘されているものの、その詳細な分子機構はよくわかっていなかった。
研究グループは、心不全を増悪させる要因として心筋細胞の早期老化現象に着目して、研究を進めてきた。加齢とともに増加する心筋細胞の老化は、心臓の機能(収縮力)を低下させることがわかっており、同グループはこれまでに、心筋細胞の早期老化が、ミトコンドリアの異常分裂により引き起こされることを報告している。
タンパク質ポリイオウ量が疾患発症リスクを規定する重要な指標に
今回の研究では、環境化学物質のひとつであるMeHgが心筋細胞に与える影響を調べるために、極めて低濃度だが食事摂取で上昇し得るレベルのMeHgをマウスに曝露させた。その結果、行動異常や体重減少などの変化は全く認められないものの、大動脈狭窄による圧負荷に対する心臓のストレス抵抗性が著しく減弱しており、心機能低下(心不全)や死亡率の増加がみられた。また、MeHg曝露マウスの心筋組織では、ミトコンドリア分裂促進分子Dynamin-related protein 1(Drp1)が異常に活性化しており、それに伴ってミトコンドリアの異常分裂が誘導されていることも明らかとなった。
研究グループの以前の研究から、Drp1異常活性化はアクチン結合蛋白質である FilaminとDrp1が複合体を形成することによって誘導されること、既承認薬シルニジピン(ジヒドロピリジン系カルシウム拮抗薬)は、Drp1-Filamin複合体形成を抑制することで、Drp1異常活性化を抑制することが明らかになっている。そこで今回、Drp1異常活性化を起こしているMeHg曝露心筋細胞にシルニジピンを投与したところ、心筋細胞のストレス脆弱性が解除された。これらの結果から、MeHg曝露によるDrp1異常活性化は、Drp1-Ffilaminタンパク質間相互作用が強まることによって引き起こされていることが示唆された。
さらに分子メカニズムを詳細に解析したところ、Drp1タンパク質のC末端に存在するシステイン(Cys-624)の側鎖がポリイオウ鎖を形成しており、MeHgは、このポリイオウ鎖と化学的に反応してイオウを引き抜く(脱イオウ化する)こと、そしてこの脱イオウ化によって、Drp1-filaminタンパク質間相互作用が強まり、Drp1が活性化することが明らかになった。そこで、Drp1ポリイオウ鎖を保護するために、硫化水素ナトリウム(NaHS)などのイオウドナーを投与したところ、MeHgによる心不全悪化を解除することに成功した。今回の研究成果は、タンパク質ポリイオウ量が環境化学物質による疾患発症リスクを規定する重要な指標となることを示すとともに、新たな心不全の予防・治療法の開発にも大きく貢献することが期待される。
▼関連リンク
・九州大学 研究成果




