パーキンソン病新薬として期待されるL型カルシウムチャネル拮抗薬
東京医科歯科大学は6月24日、ミクログリアに発現するL型カルシウムチャネルの Cav1.2が神経変性疾患において果たしている役割をつきとめたと発表した。この研究は、同大学院医歯学総合研究科細胞薬理学分野の田邊勉教授、三枝弘尚助教、王馨爽大学院生らの研究グループによるもの。研究成果は「Scientific Reports」に同日付で掲載された。
画像はリリースより
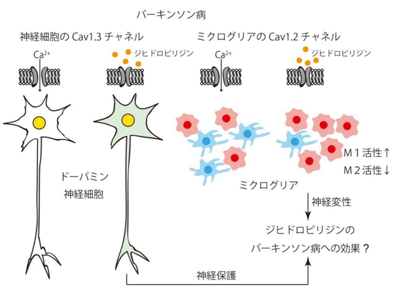
パーキンソン病は振戦や姿勢反射障害等の症状を示す進行性の神経変性疾患で、中脳黒質のドーパミン神経細胞が細胞死を起こし減少していくことが発症の原因と考えられている。現在の治療法は脳内に不足するドーパミンを補うレボドパ(ドパ脱炭酸酵素阻害薬:DCI配合)等のドーパミン補充療法が主流で、パーキンソン病を根本的に治療できるものではない。
一方で、黒質のドーパミン神経細胞にはL型カルシウムチャネル、Cav1.3が存在し、このチャネルの活性を抑制するとドーパミン神経細胞死が抑制されると考えられている。最近、L型カルシウムチャネルの拮抗薬が、ドーパミン神経細胞死を抑制して病気の進行を防ぐ根本的な治療薬になるのではないかと期待されている。今回研究グループは、L型カルシウムチャネルの拮抗薬のパーキンソン病に対する治療薬としての可能性について、分子メカニズムからのアプローチにより検証をした。
M1型活性化を促進し、M2型活性化を抑制する薬
研究グループはまず、パーキンソン病の病態と密接に関わるミクログリアにおいて L型カルシウムチャネルの一つCav1.2が発現していることを見出した。次に、L型カルシウムチャネル拮抗薬のミクログリア活性化に対する影響を、培養ミクログリア細胞で調べた。その結果、L型カルシウムチャネル拮抗薬は、M1型活性化を促進し、M2型活性化を抑制することが判明。これにより、ミクログリアのL型カルシウムチャネルを抑制すると神経変性が起きやすくなることが予想された。
そこで、Cav1.2チャネルの発現を時期特異的かつミクログリア特異的に抑制可能な遺伝子改変マウス(Cav1.2KDマウス)を作製し、この仮説を検証した。具体的には、このマウスにMPTP(黒質のドーパミン神経細胞を選択的に障害する薬物)を投与して、パーキンソン病様の病態を引き起こし、Cav1.2 KDマウスのパーキンソン病様症状がどのように変化するかを調べた。その結果、行動学的実験により、Cav1.2 KDマウスは野生型マウスと比べ、行動失調が激しいことが観察されました。また、組織学的解析から、黒質のドーパミン神経細胞の数や線条体(黒質から投射されるドーパミン神経の終末が観察される部分)のドーパミン神経線維終末の数が、野生型マウスよりCav1.2KDマウスで少ない傾向が見出された。
Cav1.2チャネルを阻害せず、Cav1.3チャネル選択性の高いものが望ましい
また、ミクログリアの活性化状態に特徴的なマーカー遺伝子の発現を調べたところ、Cav1.2KDマウス黒質では野生型よりM1型活性化のマーカーを発現するミクログリアの数が20%程度多く、M2型活性化のマーカーを発現するミクログリアの数は20〜25%程度少ないという結果が得られた。線条体のミクログリアのM1、M2型マーカー遺伝子発現は、黒質と同様の傾向にあった。
これらの結果から、ミクログリアのCav1.2チャネルの発現を低下させた場合、MPTP投与により誘導されるミクログリアの活性化パターンが野生型と比較して変化する(炎症促進性のM1型が多くなり、炎症抑制性のM2型が少なくなる)ことが明らかになった。このようなミクログリア活性化パターンの変化によって、黒質に存在するドーパミン神経細胞死が促進され、パーキンソン病様症状が悪化すると研究グループは考察。ミクログリアにおけるCav1.2チャネルの本来の機能は、M1型活性化を抑制しM2型活性化を促進することにより神経細胞を保護するように働くものである可能性があるという。
最近L型カルシウムチャネル拮抗薬「イスラジピン」のパーキンソン病に対する治療効果を調べる臨床試験が行われたが、結果は思わしくなかった。本研究の成果から、イスラジピンがミクログリアのCav1.2チャネルも同時に阻害したことにより神経細胞のCav1.3チャネルの阻害によってもたらされる神経細胞保護的効果が相殺されたのではないかと考えられる。従って、「L型カルシウムチャネル拮抗薬をパーキンソン病治療に応用する場合は、Cav1.2チャネルの阻害効果の少ないもの、よりCav1.3チャネルに対する選択性の高いものが望ましいと考えられる」と、研究グループは述べている。
▼関連リンク
・東京医科歯科大学 プレス通知資料



