小胞体ストレス時の細胞死スイッチについて研究
東京薬科大学は6月13日、小胞体ストレスにおいて、ミトコンドリアと小胞体の連携的なシグナル調節が細胞の生と死を決定することを解明したと発表した。この研究は、同大生命科学部の武田啓佑研究員、柳茂教授らの研究グループによるもの。研究成果は、欧州科学誌「EMBO Journal」電子版に掲載されている。
画像はリリースより
小胞体で異常なタンパク質が蓄積することによって引き起こされる「小胞体ストレス」は、アルツハイマー病などの神経変性疾患、炎症やがんなどの加齢性疾患に関与することが報告されている。小胞体でのタンパク質合成に異常が生じると、細胞はそのストレスを解消しようと試みるが、あるポイントを境に、自発的な細胞死を選択する。老化すると小胞体ストレスの感受性が高まって細胞死が高頻度で発生することにより、老化関連疾患の発症へ至ると考えられている。これまでに、小胞体ストレス時の細胞死スイッチが小胞体センサー分子であるIRE1αによって行われることは知られていたが、そのメカニズムは不明だった。
研究グループはこれまで、ミトコンドリア外膜に存在するMitochondrial Ubiquitin Ligase (MITOL)というタンパク質を同定し、これがユビキチン鎖という制御シグナルを使うことで、ミトコンドリア膜での多様な細胞応答を支配していることを明らかにしてきた。
ミトコンドリアのMITOLがIRE1αを制御し、細胞死を抑制
MITOLがミトコンドリア膜の中でも、小胞体と近接した膜領域において豊富に存在したことに着目し「MITOLはミトコンドリアのみならず、小胞体から惹起されるシグナル応答にも関与できる」との仮説をもとに、解析を行った。
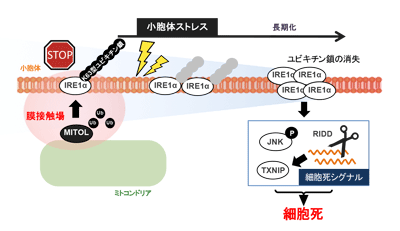
最初に、MITOLを欠損した細胞を用いて、小胞体でのストレス応答性を調査。その結果、MITOL欠損細胞では、ミトコンドリアのみならず、小胞体のストレスに対しても過敏な応答を示し、早期から細胞死スイッチが認められた。このとき、小胞体でのストレス感知を担うIRE1αというセンサータンパク質が、非常に強く活性化していることが判明。加えて、MITOLが欠損すると、小胞体ストレスを排除してもIRE1αの活性化が長く保持されることがわかった。これは、MITOLのない状態でIRE1αがストレスを感知すると、そのストレス応答がいつまでも終息しないということを示している。この結果から、このIRE1αの過度で持続的な活性化が、小胞体ストレスにおいて細胞死を引き起こすことが明らかになった。
次に、小胞体ミトコンドリア間の膜接触領域を破壊すると、その結合が失われたことから、MITOLとIRE1αは両細胞小器官の膜接触を足場として、結合することが示された。このとき、MITOLはIRE1αによる細胞死シグナルが誘導されないよう、IRE1αにK63型ユビキチン鎖という制御シグナルを付加していることが判明。IRE1αは小胞体ストレスを感知しても、一定時間でその活性を終息させるため、細胞死シグナルが誘導されないと考えられた。さらに、それを証明するためMITOLによるユビキチン鎖を付加できないIRE1α変異体を作製し細胞に導入。その結果、細胞は小胞体ストレスに対し、早期からの細胞死スイッチを示し、過剰な細胞死へと至った。また、MITOLによるIRE1αの制御は、小胞体ストレスの長期化に伴い消失した。これらの発見で、小胞体ストレスにおいて、細胞運命が決定される仕組みを説明することが可能となった。
また、研究グループのモデルにはMITOLによる制御シグナルが付加されており、小胞体に変性タンパク質が蓄積しても、それが軽度のストレスであれば、即座にストレスは解消され、IRE1αによるストレス応答も無事終息する。しかし、小胞体におけるストレスが解消できない場合は、MITOLによるIRE1αの抑制効果は次第に減弱する。その結果、IRE1αが過剰に活性化してしまうことで、細胞死シグナルのスイッチが押されてしまう。MITOL欠損細胞では、IRE1αの過剰活性化を終息させる機構が最初から欠失しているため、小胞体ストレスの早期より細胞死スイッチが観察され、過剰な細胞死を引き起こしたものと考えられる。
MITOL活性化薬が加齢性疾患の治療薬になる可能性も
今回の発見は、小胞体ストレスにおける細胞死の回避へとつながる新しい治療標的として、全く別の細胞小器官ミトコンドリアの活性化が利用できる可能性を示している。また、このような細胞小器官ネットワークによる相補的・連携的なシグナル制御の理解が進めば、特定の細胞小器官の異常を回復するために、異なった細胞小器官の制御系を含めた広域な標的分子を利用可能となり、これからの治療実現性をより高めることが期待できる。
研究グループは、「現在、MITOLを活性化する薬剤をスクリーニングしており、すでに複数の化合物を同定している。まだ予備的な実験段階だが、マウスを用いた実験系においてもこれらの化合物の抗老化作用が確かめられている。今後、MITOL活性化薬は小胞体ストレスが関与するさまざまな加齢性疾患の治療薬になる可能性が期待される」と、述べている。
▼関連リンク
・東京薬科大学 プレスリリース



