細胞分裂方向の異常はがんの形成に関与
東北大学は6月7日、生体上皮組織における細胞分裂方向を制御する新規メカニズムを、ショウジョウバエモデルを用いて解明したと発表した。この研究は、同大学際科学フロンティア研究所の中嶋悠一朗助教(生命科学研究科兼任)が、アメリカのストワーズ医学研究所のMatthew Gibson(マシュー・ギブソン)博士と共同で行ったもの。研究成果は、米国の国際科学誌「Journal of Cell Biology」に掲載されている。
画像はリリースより
上皮組織は外界からのバリアーとして働き、体の器官は上皮シートからできた袋や管の変形によってできている。上皮組織はヒトを含む多細胞動物の体をつくるうえで最も基本的な組織といえるが、その一方で、がんの約80%以上が上皮由来であるように、上皮組織に由来する疾病は数多く存在する。発生過程や成体の恒常性維持において、上皮細胞の多くはシート構造に対して平行な細胞分裂を行う。近年、細胞分裂方向の異常は腫瘍形成への関与が指摘され、その制御機構の重要性が認識されているが、生体内上皮において細胞分裂方向を制御する仕組みの多くは未解明だ。
これまでに研究グループは、ショウジョウバエを用いた研究によって、がん抑制因子であるScribとDlgが、上皮と平行な細胞分裂方向の制御に関与することを示唆した。ScribやDlgによる細胞分裂方向の制御は、魚やニワトリ、マウスでも報告されており、進化的に保存された仕組みであると考えられる。しかし、上皮の極性を制御することで知られるScribやDlgが、どのようにして細胞分裂方向の決定に関与しているのか、その正確なメカニズムはわかっていなかった。
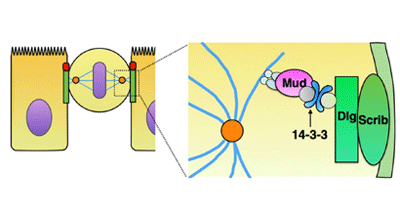
がん抑制因子ScribとDlgが14-3-3と相互作用して細胞分裂方向を制御
今回、研究グループは、ショウジョウバエ上皮組織をモデルとして、ScribとDlgが上皮と平行な細胞分裂方向の決定に関与する、その詳細な分子細胞メカニズムの解明に挑んだ。まず、細胞分裂方向が決定されるプロセスを理解するために、分裂期スピンドルの動態をライブイメージング解析したところ、分裂期スピンドルが上皮と平行になる過程で特徴的なダイナミクスを見出すことに成功。また、遺伝学的な操作によってScribやDlgの機能を阻害したところ、分裂期スピンドルの動態がランダムになったことから、ScribやDlgは分裂期スピンドルの正しい動態を制御することが示唆された。さらに、変異体を使った遺伝学的解析から、ScribはDlgの上皮細胞における局在を制御していることも判明した。
ここで、上皮細胞の細胞間結合部位に局在するScribやDlgが、どのようにして分裂期スピンドルを制御するのかを調べるために、Dlgタンパク質複合体のプロテオミクス解析を行い、14-3-3タンパク質(14-3-3ε/14-3-3ζ)を候補因子として同定。変異体やRNAiで機能阻害した実験から、14-3-3タンパク質が上皮と平行な細胞分裂方向の制御に必要であることがわかった。また、分裂方向の異常に加えて、アポトーシスや組織からの脱落といった組織構造の破綻が観察された。さらに、14-3-3タンパク質はScribやDlg、および分裂期スピンドルの制御因子であるMudと遺伝学的および生化学的な相互作用を示したことから、14-3-3タンパク質が、ScribとDlgを介した細胞分裂方向の制御に重要な働きをすることが明らかになった。
細胞分裂方向の異常は、組織の構造や恒常性の破綻につながることがさまざまな動物モデルで示唆されていることから、今回の研究で見出された細胞分裂方向を制御する仕組みが、がんをはじめとした上皮に由来する病態発症メカニズムの理解につながることが期待される。
▼関連リンク
・東北大学 プレスリリース



