骨髄腫のクローン進化に関与するAPOBEC3Bを詳しく解析
京都大学は6月7日、がんに遺伝子変異を導入する酵素APOBEC3Bの分子スイッチを発見したと発表した。この研究は、同大医学研究科の高折晃史教授、医学部附属病院血液内科の白川康太郎助教、医学研究科の松本忠彦研究員らの研究グループが、国立感染症研究所病原体ゲノム解析センター、株式会社セルフリーサイエンスと共同で行ったもの。研究成果は、国際学術誌「Scientific Reports」のオンライン版に掲載されている。
画像はリリースより
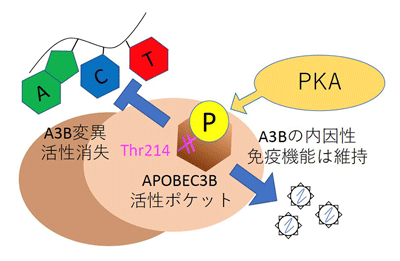
がんが難治性である原因のひとつは薬剤耐性化であり、薬剤耐性化には、がんの遺伝子に変異が蓄積することで起きるクローン進化が大きく寄与していると考えられている。APOBECタンパク質は、DNAシトシン脱アミノ化反応を触媒し、結果としてシトシンをチミンに変換して遺伝子変異を引き起こす。APOBECタンパク質は、元々はウイルスの遺伝子に変異を導入することで、ウイルス感染に対する内因性免疫として機能することが知られていたが、近年さまざまな報告により、このタンパク質が多くのがん種でクローン進化を引き起こすことが明らかになってきた。APOBECファミリーである、APOBEC3GはプロテインキナーゼA(PKA)によりリン酸化され、その分子学的機能が調整されていることがすでに知られていた。また、これまでに研究グループは、は骨髄腫のクローン進化に内在性のDNAシトシン脱アミノ化酵素であるAPOBEC3Bが関与していることを明らかにした。APOBEC3Bは変異源となり得るため、厳密に酵素活性が調整されているはずだが、現在までこの酵素活性を生理的に抑制する機構は知られていなかった。
APOBEC3Bのリン酸化は、新たなコンセプトのがん治療の一つの戦略に
研究グループは今回、APOBEC3BとAPOBEC3Gの配列を比較することで、APOBEC3Bに2か所、PKAによってリン酸化されうるアミノ酸を同定した。次にPKAが実際にAPOBEC3Bをリン酸化することと、リン酸化されるアミノ酸が214番目のスレオニン(Thr214)であることを発見。さらに、Thr214のリン酸化によってAPOBEC3Bの酵素活性が失われることを明らかにした。その原因として、基質であるシトシンがThr214に付加されたリン酸基の負電荷により酵素活性部位に侵入できなくなることが、コンピューターシミュレーションの結果から推定された(国立感染症研究所病原体ゲノム解析研究センターの横山勝主任研究官、佐藤裕徳室長との共同研究)。一方で、リン酸化を受けても、元来APOBEC3Bが有している内因性免疫機能である抗レトロトランスポゾン活性、抗レトロウイルス活性は依然保持していたという。
これまで、APOBEC3Bの翻訳後修飾はサルのウイルスタンパク質によるもののみ知られていたが、今回の研究はヒトのタンパク質によるリン酸化がAPOBEC3Bの分子スイッチとして働くことを世界に先駆けて発見したという点で大変重要な意味を持つという。「この研究結果は、PKA活性化によるAPOBEC3Bのリン酸化はその内因性免疫機能を損なうことなく、『遺伝子変異を制御し、従来の抗がん剤治療への感受性を維持する』という新たなコンセプトのがん治療の一つの戦略となりうることを示唆する」と、研究グループは述べている。
▼関連リンク
・京都大学 研究成果




