対症療法ではなく、アレルギー根治療法の開発に向けて
筑波大学は5月30日、アレルギー発症の原因となる肥満細胞の活性化を肥満細胞が自ら抑制し、アレルギーを抑える仕組みがあることを世界で初めて発見したと発表した。この研究は、同大学生存ダイナミクス研究センター(TARA)の渋谷彰教授、医学医療系の小田ちぐさ助教らの研究グループによるもの。研究成果は、米国科学誌「Journal of Allergy and Clinical Immunology」のオンライン速報版に同日付で公開された。
画像はリリースより
肥満細胞上のIgE受容体に、アレルギーの原因となる抗原と結合したIgE抗体が結合すると、肥満細胞が活性化し、炎症反応を誘導するヒスタミンを代表とする種々の化学物質が肥満細胞から放出され、アレルギー症状が出現する。これはどのアレルギー疾患にも共通するアレルギー発症の基本的なメカニズムといえる。これまでアレルギーに対しては、ヒスタミンの働きを抑える薬剤を中心として治療が行われてきたが、対症療法の域を出ないために効果も限定され、より根本的な治療法の開発が望まれていた。
生きた肥満細胞膜上のPS+CD300aが活性を抑えてアレルギーを軽快
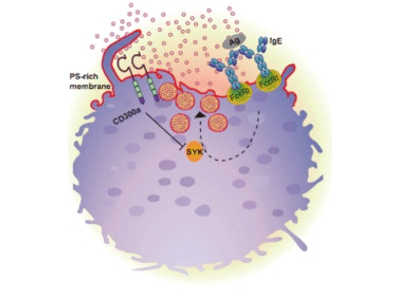
リン脂質であるフォスファチジルセリン(PS)は、細胞膜の内側に局在する細胞膜構成成分で、細胞が死ぬと細胞膜外側に表出してくることが知られており、死細胞に特異的なマーカーと考えられてきた。しかし今回、アレルギー抗原と結合し活性化した肥満細胞では、活性化後10分程度経過すると、生きている状態でもフォスファチジルセリンが細胞膜外に現れてくるという、これまでの常識を覆す現象を初めて見出した。
研究グループは以前、肥満細胞などの細胞膜上に発現するCD300aというタンパク質を発見し、さらにCD300aがPSと結合することを見出していた。そこで、肥満細胞上のCD300aが、活性化した後に細胞膜外に出てくるPSと結合する可能性を検討するために、アレルギー抗原で活性化させた肥満細胞について、FRET (蛍光共鳴エネルギー移動)を用いて解析。その結果、肥満細胞において、CD300aとPSが結合することを示す証拠が得られた。
また、肥満細胞をアレルギー抗原で活性化し、アレルギーの直接の原因となるヒスタミンなどの化学物質を含む顆粒を放出させたところ、PSと結合したCD300aは、それらの化学物資の放出を減少させた。さらに、マウス生体内において、CD300aは肥満細胞膜上のPSと結合し、 アナフィラキシーを軽快させたという。
これらの結果から、アレルギーの原因細胞である肥満細胞は、自らを制御してアレルギーを抑える仕組みを持っていることが明らかとなった。今後、「CD300aの働きを増強する薬剤を開発することで、これらのアレルギー疾患の革新的な治療につながると期待される」と、研究グループは述べている。
▼関連リンク
・筑波大学 プレスリリース



