カスパーゼ1がアポトーシスを誘導する細胞とパイロトーシスを誘導する細胞がある
金沢大学は5月23日、細胞死を引き起こすタンパク質分解酵素であるカスパーゼ1が、細胞質タンパク質「ガスダーミンD」の有無により異なるプログラム細胞死を引き起こすことを明らかにしたと発表した。この研究は、同大がん進展制御研究所の須田貴司教授、がん進展制御研究所/新学術創成研究機構の土屋晃介助教らの研究グループによるもの。研究成果は、英国科学誌「Nature Communications」のオンライン版に掲載されている。
画像はリリースより
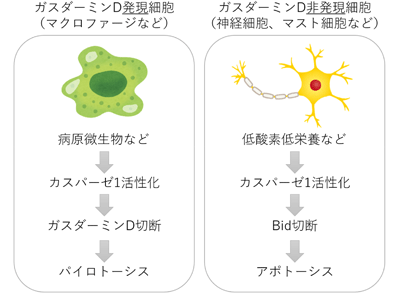
生体にとって不要な細胞や危険な細胞の多くは、細胞自身の自殺プログラムが活性化することで自殺する。このような細胞死はプログラム細胞死と呼ばれ、近年、分子メカニズムや形態的特徴の違いによって、アポトーシスやパイロトーシスなどさまざまなプログラム細胞死が存在することが分かってきた。アポトーシスの実行段階では、ヒトでは10種類ほど存在する「カスパーゼ」と呼ばれるタンパク質分解酵素群が自殺酵素として働くことが分かっている。脳梗塞やアルツハイマー病などの神経疾患の動物モデルでは、カスパーゼ1が神経細胞にアポトーシスを誘導すると報告されている。一方、その後の研究で、細菌などに寄生されたマクロファージにおいては、カスパーゼ1が、ネクローシス様のプログラム細胞死を誘導すると報告され、この細胞死は「パイロトーシス」と名付けられた。つまり、カスパーゼ1がアポトーシスを誘導する細胞と、パイロトーシスを誘導する細胞の両方存在しており、その理由を分子機序から説明することはこれまで困難だった。
また最近、ガスダーミンDと呼ばれるタンパク質がカスパーゼ1によって切断されることで、パイロトーシスを引き起こすことが明らかにされた。しかし、ガスダーミンD遺伝子を破壊したマクロファージにおいても、カスパーゼ1が活性化すると細胞死に至ることから、ガスダーミンDに依存しないカスパーゼ1誘導細胞死が存在すると考えられている。しかし、それがどのような細胞死で、どのような機序で起きるのかについては明らかにされていなかった。
パイロトーシスはガスダーミンD依存、アポトーシスはBid依存
研究グループは、野生型マクロファージにサルモネラ菌を感染させるとパイロトーシスを起こすのに対し、ガスダーミンD欠損マクロファージに同じサルモネラ菌を感染させるとアポトーシスを起こすことを見出した。カスパーゼ1欠損マクロファージでは細胞死そのものが強く抑制されることから、どちらの細胞死もカスパーゼ1によって誘導されることは明らかと推察された。
そこで、ガスダーミンD欠損細胞を用いて、カスパーゼ1の活性化により誘導される細胞死に必要な他のカスパーゼを調べたところ、広汎なアポトーシスの誘導に必要なカスパーゼ3とともに、ミトコンドリアから放出されたチトクロムCに応答して活性化されるカスパーゼ9も関与していることが判明。続けて、カスパーゼ1によって切断されることが報告されているタンパク質を調べたところ、ミトコンドリアからのチトクロムCの放出を制御するBidと呼ばれる細胞質のアポトーシス誘導タンパク質が浮上した。さらに、ガスダーミンDとBidを二重に欠損した細胞を作製し、カスパーゼ1の活性化を誘導したところ、ガスダーミンDのみを欠損した細胞に比べ、ガスダーミンDとBidを二重に欠損した細胞ではアポトーシスが抑制されることが判明した。これらの結果から、ガスダーミンD欠損マクロファージでは、代わりにBidがカスパーゼ1によって活性化され、アポトーシスを誘導することが明らかになった。
過去の研究で、筋委縮性側索硬化症モデルマウスにみられる脊髄神経細胞死と低酸素・低グルコース条件で誘導される大脳皮質神経細胞死で、カスパーゼ1が3/7アポトーシスの誘導に関与しているとともに、この時Bidの活性化を伴うことが報告されていた。しかし、これらの神経細胞死にBidが必要かどうかや、脊髄や大脳皮質の神経細胞がガスダーミンDを発現しているかどうかについては明らかにされていなかった。
そこで、メッセンジャーRNAやタンパク質の発現を解析したところ、脊髄や大脳皮質の神経細胞は元々ガスダーミンDをほとんど発現していなかった。また、カスパーゼ1欠損マウスと、Bid欠損マウスの大脳皮質の神経細胞を低酸素・低グルコース条件で培養すると、どちらも野生型の神経細胞に比べてアポトーシスを起こしにくいことが分かった。さらに、公開された遺伝子発現データベース「BioGPS」を調べることで、免疫細胞の一種であるマスト細胞がカスパーゼ1とBidを発現し、ガスダーミンDの発現は低いことを見出した。そこで、マクロファージにパイロトーシスを誘導することが知られている細菌毒素ニゲリシンでマスト細胞を刺激したところ、カスパーゼ1の活性化に伴い、Bid依存性のアポトーシスが誘導されることが判明。以上のことから、元々ガスダーミンDの発現が低い神経細胞やマスト細胞でも、カスパーゼ1がBidを活性化することで、アポトーシスを誘導することが明らかになった。
細胞死に起因する疾患の予防法や治療法の向上への貢献に期待
カスパーゼ1はマクロファージや神経細胞以外にもさまざまな組織、臓器に発現しており、心筋梗塞や腎障害などの疾患との関連も示唆されている。今後、これらの臓器におけるカスパーゼ1依存性細胞死がガスダーミンD依存性パイロトーシスなのか、Bid依存性アポトーシスなのか、あるいは別の細胞死メカニズムが存在するか解明する必要がある。
研究グループは、「それぞれの細胞死メカニズムを解明するとともに、それらに選択的な阻害剤を開発することで、将来、細胞死に起因するさまざまな疾患の予防法や治療法の向上につながることが期待される」と、述べている。
▼関連リンク
・金沢大学 研究トピック




