過剰なPLP1の発現を低下させる遺伝子治療法を開発
国立精神・神経医療研究センター(NCNP)は5月16日、小児の難病である先天性大脳白質形成不全症の代表的疾患ペリツェウス・メルツバッハ病(PMD)に対する新しい遺伝子治療法を開発したと発表した。この研究は、NCNP神経研究所 疾病研究第2部の李コウ研究員や井上健室長らの研究グループが、日本医科大学生化学/分子生物学の岡田尚巳教授と共同で行ったもの。研究成果は、「JCI Insight」オンライン版に掲載されている。
画像はリリースより
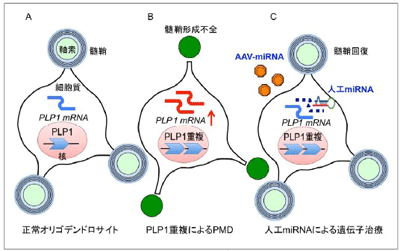
近年、遺伝子解析技術の進歩により多くの遺伝性疾患の原因が明らかになってきたが、治療法がある疾患はまだほんのわずか。PMDを代表とする先天性大脳白質形成不全症も同様で、これまで治療法がなかった。PMDは、PLP1という遺伝子の異常により、大脳をはじめとする中枢神経系全体の髄鞘(ミエリン)を正常に作れないことが原因で起こる。生後間もなく運動および認知の発達が止まり、痙性対麻痺や失調、ジストニア、眼振などのさまざまな神経学的症状が見られる小児希少性神経難病のひとつで、日本での患者数は100~200人ほどと推定されている。
PMDを引き起こす遺伝子変異のうち、最も頻度が高いのはPLP1遺伝子のゲノム重複で、正常なPLP1遺伝子の数が1個から2個に増えるため、PLP1のメッセンジャーRNA(mRNA)が増え、さらにPLP1タンパク質が過剰に作られることが疾患の原因と考えられている。そこで研究グループは、この過剰なPLP1の発現を低下させる遺伝子治療法を開発できれば、この疾患を治療できるのではないかと考えた。
新規プロモーター開発でAAVベクターの有効化に成功
研究グループはまず、特異的かつ高効率でPLP1遺伝子の発現を低下させる遺伝子治療の技術開発を行った。ここでは、人工miRNAの使用と髄鞘を作る細胞であるオリゴデンドロサイトに特異的なプロモーターの開発が重要。そこで、近年、遺伝子治療のベクターとして実用化の期待が高くなっているAAVベクターに、オリゴデンドロサイト(グリア細胞のひとつで髄鞘を作る細胞)特異的プロモーターで人工miRNAを発現できる仕組みを構築した。
人工miRNAは、特定の遺伝子のmRNAを分解することで発現を低下させることができるツール。通常、生体内にあるmiRNAは複数の遺伝子の発現を低下させるが、特定の遺伝子に特有の配列(今回はPLP1遺伝子)を用いてmiRNAを作ると、標的の遺伝子のみの発現を低下させることができる。さらに人工miRNAを標的の細胞(今回はオリゴデンドロサイト)だけで発現するようにコントロールすることで、不特定の細胞に効果が及ぶことを防げる。今回、用いたオリゴデンドロサイト特異的プロモーターは、新規に設計したもので、これを用いることにより、これまでAAVベクターによる遺伝子治療が困難と考えられていたオリゴデンドロサイトで、非常に高い特異性と効率性で遺伝子を導入することができるようになったという。
PMDの初めての治療法として期待
作成したPLP1特異的遺伝子発現抑制AAVベクター(scAAV.CNP.Venus.Plp1miRNA)を野生型マウスの脳に直接投与したところ、脳の中の広い範囲に拡散し、オリゴデンドロサイト特異的にPLP1遺伝子の発現を効果的に低下させた。次にPMDのモデルマウスであるPLP1トランスジェニックマウスの脳に同ベクターを投与したところ、通常生後40日までに全て死亡するマウスが、最大76日まで生存し、体重も維持できた。これらのマウスの脳を観察したところ、オリゴデンドロサイトに異常蓄積していたPLP1が消え、オリゴデンドロサイトの数も増え、変性している細胞の数も減っていたという。さらに、髄鞘に特異的な他のタンパク質の発現も回復し、髄鞘の形や厚さも回復することが判明。またこの治療効果に伴って、脳の中に起こっていた炎症反応(グリオーシスやミクログリアの活性化)も抑えられていた。これらの治療効果の結果、マウスの運動機能も回復していることが確認された。
今回の研究成果により、これまで治療法がなかったPMDに初めて治療ができる可能性が出てきた。今後は、PMDの患者さんの治療に向けてこの遺伝子治療法を実用化するために、より安全かつ効果的なものに改善させていく必要がある。「この技術を応用することで、これまでの遺伝子治療では対象外とされ、治療法が見つかっていない多くの疾患の治療法開発が可能になると期待される」と、研究グループは述べている。



