iPSは細胞株によって分化傾向にバラつきが
日本医療研究開発機構(AMED)は5月15日、ヒトiPS細胞株の分化傾向を予測するためのマーカー遺伝子としてSALL3を同定したと発表した。この研究は、国立医薬品食品衛生研究所再生・細胞医療製品部の佐藤陽治部長、安田智室長、黒田拓也主任研究官らの研究グループと、藤田医科大学医学部 松山晃文教授との共同研究によるもの。研究成果は英国科学雑誌「Nature Communications」に同日付で掲載された。
画像はリリースより
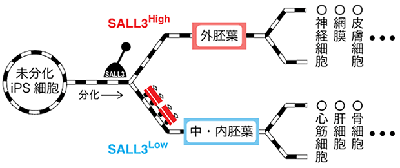
ヒトiPS細胞は多分化能を持ち、三胚葉(内胚葉・中胚葉・外胚葉)全ての系譜に分化できる。一方で、細胞株によって各系譜への分化傾向(分化のしやすさ)に、バラツキがあることが明らかになっている。そのため、目的細胞に分化しやすい細胞株を選択することは、ヒトiPS細胞由来製品を製造する上で非常に重要なポイントと考えられる。このバラツキの原因は明らかになっておらず、分化しやすい細胞株を選択するためには、実際に分化をさせて調べる必要がある。そのため、ヒトiPS細胞の未分化状態での分化傾向予測マーカーの必要性が高まっていた。
SALL3の発現が高いと外胚葉への分化促進
今回の研究では、10株のヒトiPS細胞を用いて分化傾向と相関の高い遺伝子を網羅的に探索することにより、分化傾向予測マーカーの同定を試みた。その結果、外胚葉に分化しやすい細胞株で発現が高く、中・内胚葉へ分化しやすい細胞株で発現の低いSALL3遺伝子を同定。また、SALL3遺伝子の過剰発現細胞株では外胚葉への分化が促進され、逆に、発現抑制細胞株では中・内胚葉への分化が促進されることを示した。さらに、SALL3の機能解析を進めた結果、SALL3はDNAメチル基転移酵素のひとつであるDNMT3Bに結合し、Wntシグナル関連遺伝子においてgene body領域のDNAメチル化を阻害することが明らかとなった。このgene body領域のDNAメチル化は、遺伝子発現を促進する働きがあることが近年報告されており、SALL3はエピジェネティック修飾を制御することにより、各胚葉への分化傾向を調節していることが考えられるという。今回の研究結果から、SALL3は特定の胚葉への分化を調節する能力があるとわかり、また、SALL3の分化傾向予測マーカーとしての有用性も強く示唆された。
目的細胞へ分化しやすいiPS細胞の選択は、自家移植で患者由来のiPS細胞を樹立するとき、他家移植で再生医療用iPS細胞ストックから細胞株を選ぶとき、また、ドラッグスクリーニングで疾患iPS細胞を樹立するときなど、さまざまな場面での活用が想定される。また、再生医療等製品を製造する上でも、SALL3を利用した目的細胞に分化しやすいiPS細胞株の選択は、最終製品への目的外細胞混入リスクの低減、最終製品へ残存未分化細胞混入リスクの低減、最終製品の収率の改善、製造工程の期間短縮などに貢献すると期待される。「同研究で用いたアプローチは、他の目的細胞への分化傾向予測マーカーの同定方法としても応用可能と考えられ、再生医療の実現化にも期待が寄せられる」と、研究グループは述べている。
▼関連リンク
・日本医療研究開発機構(AMED) プレスリリース




