よく似た糖鎖CSとHSはなぜ真逆の働きをするのか
名古屋大学は5月7日、異なる糖鎖が神経軸索の伸長を制御する分子メカニズムを明らかにしたと発表した。この研究は、同大大学院医学系研究科分野の門松健治教授、坂元一真助教、尾崎智也特任助教の研究グループが、台湾中央研究院のShang-Cheng Hung教授、鳥取大学の田村純一教授らと共同で行ったもの。研究成果は「Nature Chemical Biology」に掲載されている。
画像はリリースより
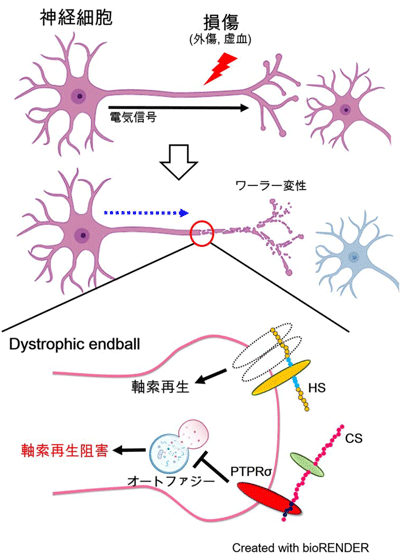
ヒトの神経回路は全長で50万キロメートルにも及ぶ。この神経回路を形成しているのが神経細胞の軸索だが、長大な神経回路は、外傷などにより容易に切断されてしまう。例えば、脊髄損傷などがこれに当てはまる。軸索が切断されると、神経細胞の一番遠くの先端は、ワーラー変性と呼ばれる変性を起こすが、近い先端(細胞体側)はまだ生きており、神経軸索は再伸長を試みる。しかし、中枢神経系の神経軸索はこの再生が強力に阻害される。この結果、神経回路は永続的に断絶され、患者には麻痺などの後遺症が残ることになる。
再生阻害の原因は、コンドロイチン硫酸(CS)という糖鎖。CSは神経細胞受容体PTPRσに結合し、神経先端部にDystrophic endballという異常球状構造を誘導してしまう。一方ヘパラン硫酸(HS)と呼ばれる糖鎖は軸索を伸長させるが、奇妙なことに、CSはHSと構造が極めてよく似ており、同じ受容体PTPRσに結合する。しかしながら、どのようにこれら2つのよく似た糖鎖が正反対の働きをするのか、長い間、不明だった。
PTPRσを多量体にするか単量体にするかがポイントだった
今回研究グループは、まず、さまざまな構造と長さを持った一連のHS、CSを化学合成し、これらを用いて解析を行った。その結果、HSは多数のPTPRσと同時に結合できるため、この受容体を多量体にするのに対し、CSは1つ、もしくは、ごく少数のPTPRσとしか同時に結合できないために、受容体を単量体にすることがわかった。さらに詳しく調べたところ、このPTPRσの状態の違いが、神経細胞に全く正反対の命令を送っていたことが判明。また、CSによりPTPRσの酵素活性が上がり、細胞内のCortactinという分子を脱リン酸化することもわかった。リン酸化Cortactinはオートファジーを完了させるのに必須の分子。そのため、脱リン酸化の結果、軸索内のオートファジーが中断されて軸索伸長が抑制され、Dystrophic endballが形成されることが明らかとなった。
今回の研究で、CS-PTPRσ-cortactin-autophagy経路という軸索伸長阻害のメカニズムが世界で初めて明らかになった。これにより神経損傷に対する有効な治療標的分子の候補が見つかった。例えば、HSオリゴ糖、PTPRσ阻害剤などは候補薬となる可能性がある。また、今回の発見は、パーキンソン病やアルツハイマー病など神経変性疾患の機構解明にも一石を投じる可能性があると研究グループは述べている。
▼関連リンク
・名古屋大学 プレスリリース




