通常の免疫応答を抑制しない理由について研究
徳島大学は4月15日、抑制性の免疫補助受容体であるPD-1(Programmed cell death 1)が、有益な免疫応答は抑制せずに、自己免疫疾患につながる免疫応答を選択的に抑制するメカニズムを解明したと発表した。この研究は、同大学先端酵素学研究所の杉浦大祐特任助教、岡崎拓教授らの研究グループによるもの。研究成果は、米国科学雑誌「Science」オンライン版に4月18日付で公開された。
画像はリリースより
PD-1は、自己組織やがん細胞を攻撃するT細胞の活性化を強力に抑制する。一方、通常のマウスやヒトでは、PD-1が機能しているにも関わらず、免疫系は正常に機能して、病原微生物などが排除され生体は防御されている。このことから、病原微生物などに対する有益な免疫応答を無力化してしまわないように、PD-1の機能は使い分けられていると考えられていたが、そのメカニズムは不明だった。
T細胞は、細胞表面に発現するT細胞抗原受容体を使って抗原を認識する。しかし、抗原を認識しただけではT細胞は活性化されず、活性化には、T細胞に発現している興奮性の免疫補助受容体CD28を介した副刺激が必須。CD28は、抗原提示細胞上に発現するCD80あるいはCD86と結合して副刺激を伝達することが知られている。
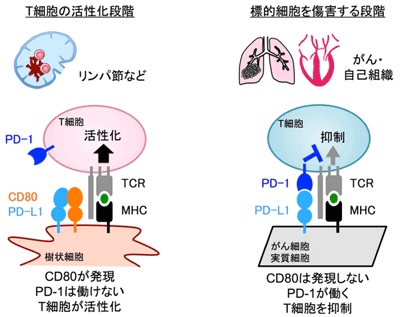
抗原提示細胞上でCD80がPD-L1とシス結合し、PD-1の結合を妨害
今回研究グループは、まず、PD-1の細胞外領域を多量体化させた可溶性タンパク質(PD-1-EC)を用いて、さまざまな種類の抗原提示細胞にPD-1が実際に結合できるかを検討した。すると、PD-1はマクロファージには結合するものの、抗原提示能のより高い樹状細胞にはほとんど結合しなかった。しかしマクロファージと樹状細胞を比べてもPD-L1の発現量にはほとんど差が無く、さらにCD80欠損マウスの樹状細胞がPD-1と強く結合したことから、CD80が樹状細胞上に発現していると、PD-1はPD-L1に結合できなくなると予測された。
そこで研究グループは、CRISPR/Cas9 を用いたゲノム編集により培養細胞のPD-L1遺伝子をいったん欠損させた後に、PD-L1、PD-L2、CD80あるいはCD86 をさまざまな組み合わせで発現させ、PD-1と結合できるかどうかを検討。その結果、予想通り、CD80が PD-L1と同じ細胞上に発現する場合にのみ、PD-1とPD-L1の結合が邪魔され、また、CD80がPD-1とPD-L1との結合を邪魔すると、PD-1はT細胞が活性化するのを抑制できなくなることがわかったという。
次に、CD80とPD-L1 にアミノ酸変異を導入して、PD-L1 と結合できないCD80変異体およびCD80と結合できないPD-L1変異体を作製し、解析。すると、CD80変異体はPD-L1と同じ細胞上に発現してもPD-L1とPD-1の結合を邪魔できず、PD-L1変異体はCD80が同じ細胞上に発現していてもPD-1と結合できると判明した。
注目すべきは、がん細胞にCD80が発現していないこと
さらに、CD80とPD-L1が結合できないノックインマウスを作製して解析したところ、ノックインマウスの樹状細胞は、野生型マウスに比べPD-1とより強く結合し、T細胞の活性をPD-1依存的に抑制した。このマウスでは、抗原特異的T細胞の活性化が著しく障害され、また、がん免疫療法によるがんの治療効果はほとんど確認されなかった。さらに、このマウスに実験的自己免疫性脳脊髄炎を起こさせたところ、野生型マウスに比べ、自己免疫疾患の発症が軽減した。今回の一連の研究は主にマウスを用いて行ったが、人のPD-L1とCD80を用いた研究でも同様のことが確認されたという。
今回の研究によって、T 細胞が抗原提示細胞によって活性化される段階において、CD80がCD28の副刺激を活性化するが、他方ではPD-1による抑制シグナルを阻害するという巧妙なメカニズムの存在が明らかとなった。ほとんどのがん細胞や臓器の実質細胞ではCD80が発現していないため、がん細胞や各種臓器の実質細胞に対するT細胞応答はPD-1により抑制されると考えられる。今回の成果は、新たな自己免疫疾患の治療法開発につながることが期待されると、研究グループは述べている。
▼関連リンク
・徳島大学 報道発表



