PDIの全く新しい触媒機構が明らかに
東北大学は4月12日、高速原子間力顕微鏡により、ジスルフィド結合導入酵素プロテインジスルフィドイソメラーゼ(PDI)が、構造未成熟な基質を捕獲する様子を可視化することに世界で初めて成功したと発表した。この研究は、同大学際科学フロンティア研究所の奥村正樹助教、同大多元物質科学研究所の稲葉謙次教授(生命科学研究科、大学院理学研究科化学専攻兼任)、熊本大学発生医学研究所の小椋光教授、野井健太郎博士(現:大阪大学ナノサイエンスデザイン教育研究センター特任助教)らの研究グループによるもの。研究成果は「Nature Chemical Biology」に掲載されている。
画像はリリースより
細胞内には、タンパク質高次構造の形成反応を促進する仕組みがある。特に構造未成熟なタンパク質の構造修復の仕組みは、生体内で不良タンパク質の蓄積を防ぐために必要不可欠である。しかし、細胞内の補助因子がどのようにして構造未成熟なタンパク質を認識し、構造修復のため働いているのかについては、よくわかっていなかった。
PDIは、PDIファミリータンパク質の1つ。哺乳動物細胞の小胞体内で、立体構造形成前のタンパク質にジスルフィド結合を導入させたり、誤って形成されたジスルフィド結合の修復などの機能を担っている。PDIの結晶構造は、4つのドメインから構成されるU字構造で、動きに富むことが示唆されていたが、この動きがPDIの機能発現にどのように関わるのかは、解明されていなかった。
さまざまな基質を還元状態で添加するとPDIが二量体化
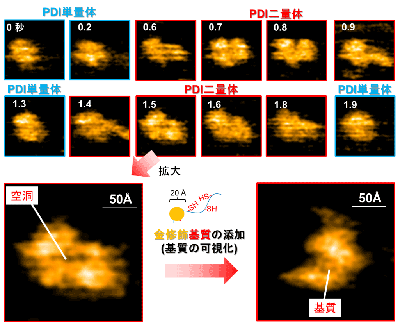
研究グループは、高速原子間力顕微鏡(高速AFM)を用いた観察により、PDIが酸化還元状態依存的に4つのドメインで構成されるU字構造の開閉を制御し、この構造制御がさまざまな基質の効率的な酸化的フォールディングの触媒に重要な役割をもつことを明らかにした。さらに、BPTI、RNaseA、ラミニン、プラスミノーゲンといった形や大きさ、ジスルフィド結合の数が異なるさまざまな基質を還元変性させた状態で添加すると、PDIが二量体化することを発見した。立体構造形成前の基質はPDI二量体の中央に形成される空洞に取り込まれ、そこで迅速なジスルフィド結合の導入と構造形成を受けることを明らかにした。
この現象は、大きさやジスルフィド結合の数が異なる複数種類の基質に対しても同様に観察されることがわかった。また、変性状態にある基質依存的に形成されたPDI二量体は、基質のフォールディング状態や構造形成しやすさ(フォールディング速度)に応じて、寿命や形状を変えることを突き止めた。このように、二量体を形成することで生じる中央の空洞中に変性基質を捕獲し、効率的な酸化的フォールディングを促すというPDIの全く新しい触媒機構が明らかにされた。
新たな知見が、神経変性疾患やフォールディング病の有用な情報に
これまでにPDIの変異や機能欠損を引き起こす化学修飾が、さまざまな神経変性疾患の患者から見つかっているが、今回の研究成果により、新たにPDIの動的性質や二量体形成が、サイズやジスルフィド結合の数が異なるさまざまなタンパク質のジスルフィド結合を効率的に導入する上で、重要な役割を果たすことが明らかになった。
研究グループは、「これらの基礎的知見は、生体内における高効率・高精度なタンパク質の構造形成促進の触媒機構の新たな解明につながり、神経変性疾患や2型糖尿病などのフォールディング病に関する有用な情報を提供するものと期待される」と、述べている。
▼関連リンク
・東北大学 プレスリリース




