インスリンシグナルの変化とAβの蓄積との因果関係を研究
東京大学は4月12日、2型糖尿病におけるインスリン抵抗性が、アルツハイマー病脳のアミロイド蓄積を促進するメカニズムを解明したと発表した。この研究は、同大大学院医学系研究科の岩坪威教授らの研究グループが、同大医学部附属病院の門脇孝特任教授、窪田直人准教授らと共同で行ったもの。研究成果は、「Molecular Neurodegeneration」に発表されている。
画像はリリースより
アルツハイマー病(AD)は老年期の認知症として最も頻度の高い疾患。AD患者の脳に特徴的な病理変化として、アミロイドβペプチド(Aβ)からなる老人斑があり、Aβの蓄積はAD発症の原因であると考えられている。また近年、2型糖尿病がAD発症のリスクを2倍に高めることが明らかにされた。特に、2型糖尿病の中心的な病態であるインスリン抵抗性が、ADの発症を促す可能性が予測されてきた。しかし、インスリンシグナルの変化とAβの蓄積との因果関係については未解明だった。
代謝ストレスが、ADの病態形成に影響
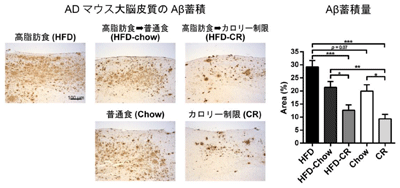
研究グループは、脳にAβの蓄積を生じるADモデルマウスを用い、高脂肪食により誘発されたインスリン抵抗性と、インスリンシグナルの鍵分子であるIRS-2の欠損に伴うインスリン抵抗性による影響を比較、解析した。
その結果、高脂肪食の負荷は末梢臓器の炎症性シグナルやストレスシグナルを増加させ、末梢や脳のインスリン抵抗性を引き起こすと同時に、脳ではAβの蓄積が増加した。一方、IRS-2を欠損すると、糖尿病を発症するものの、Aβの蓄積は抑制された。しかし、IRS-2欠損マウスに対して持続的に高脂肪食を負荷すると、糖尿病病態の悪化とともに、Aβの蓄積は再び増加。つまり、食餌誘導性のインスリン抵抗性によってのみ、ADの病態が促進されることが分かった。これらの結果は、インスリンの作用低下そのものではなく、インスリン抵抗性発症の要因となる代謝ストレスが、Aβの脳内の除去速度を低下させ、結果として蓄積を促進することを示しているという。また、高脂肪食負により脳のAβが増加しても、その後に食事制限を行うことでインスリン抵抗性が改善し、その改善の程度に応じて脳のAβ蓄積も可逆的に減少することも明らかとなった。
さらに同研究では、これまで詳細が未解明だった、インスリンやAβの脳内での動態を解明するため、脳の細胞間隙に存在するタンパク質を回収可能な微小透析法を用いた解析を行った。その結果、高脂肪食の摂取による糖尿病状態では血液中から脳へのインスリンの移行が低下することにより、脳でもインスリン抵抗性が生じる可能性が示された。また同時に、糖尿病状態のモデルマウスの脳内では、Aβの除去速度が低下することで、アミロイド蓄積が増加する可能性も明らかにされた。
代謝ストレスの経路特定と介入法の解明で、新規予防・治療戦略創出を目指す
近年、インスリン抵抗性がADの発症に関与するという知見に基づき、糖尿病治療薬や、インスリン経鼻投与などの、インスリンシグナルの賦活化を標的としたADの予防・治療法が模索され始めている。
研究グループは、「本研究で我々は、ADのアミロイド病態とインスリン抵抗性との因果関係を、2種類のモデルを用いて解析することによって、代謝ストレスがAD病態形成に重要な影響を与えることを示した。すなわち、末梢や脳における小胞体ストレスや慢性炎症を標的とすることによって、AD発症の原因であるAβ病態の形成を抑制できる可能性が示唆された。今後は、より具体的な代謝ストレスの経路の特定と、介入法を解明することにより、新たなADの予防・治療戦略の創出に繋がると期待される」と、述べている。
▼関連リンク
・東京大学大学院 医学系研究科・医学部 プレスリリース



