新たな希少難病の原因遺伝子を探る
理化学研究所は4月12日、骨と脳を侵す新たなタイプの難病の原因遺伝子「CSF1R(コロニー刺激因子1受容体)」を発見し、同分子の機能喪失が、広範かつ多様な骨格、脳神経系の異常を引き起こすことがわかったと発表した。この研究は、理研生命医科学研究センター骨関節疾患研究チームの池川志郎チームリーダー、郭龍研究員らによるもの。研究成果は、日本時間の同日、米国人類遺伝学会の機関誌「American Journal of Human Genetics」オンライン版に掲載された。
画像はリリースより
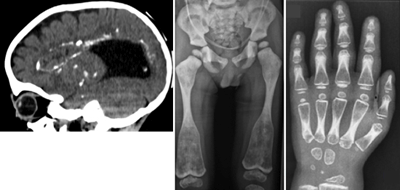
骨や関節をはじめとする運動器には、多くの遺伝性難病がある。同研究グループは骨関節の遺伝性難病の原因遺伝子を同定し、画期的な診断法・治療法の開発を行っている。また、これら原因遺伝子の機能解析を通じて、骨格の成長・発達・維持のメカニズムの解明を目指していた。これまでにも、全世界の医師・研究者と協力し、原因遺伝子が未知の骨関節の難病の臨床データ、画像データ(X線写真、CTなど)を収集・解析し、表現型の解明、原因遺伝子のゲノム解析などの多面的研究を行い、29疾患の原因遺伝子を世界に先駆けて発見していた。
大規模シーケンス解析で、CSF1Rの機能喪失変異と判明
これらの研究のなかで、最近収集した難病患者の中に、共通の骨格、脳神経系の異常を持つ3家系7人の患者を発見。骨格には、全身の骨硬化、脊椎の形成異常、長管骨と短管骨の骨幹端部の拡大などの特徴的な異常が、脳には、脳室周囲の石灰化を伴う白質脳症様の神経変性とダンディ・ウォーカー奇形などの脳奇形が認められた。このような骨格、脳神経系の異常の組み合わせは過去に報告がなく、新たな症候群であると考えられ、今回、その原因遺伝子の同定を試みた。
研究グループは、全エクソームシーケンス解析、全ゲノムシーケンス解析などの大規模シーケンス解析により、この3家系の遺伝子変異を探索・解析した。その結果、7人の患者全員がCSF1R遺伝子の両方の対立遺伝子座位(アレル)に遺伝子の機能を喪失するタイプの塩基変化を持つことが判明。3家系の内の家系Aの患者は、ナンセンス変異c.1441C>T(p.Gln481*)とミスセンス変異c.395C>T(p.Pro132Leu)の複合ヘテロ接合体、家系Bの患者は、イントロン変異c.1859-119G>A(p.S620C_T621ins39)と1アミノ酸の欠失変異c.1879_1881del(p.Lys627del)の複合ヘテロ接合体、家系Cの患者は、イントロン変異c.1969+115_1969+116delAG(p.P658Sfs*24)のホモ接合体だった。これら計5つの変異の機能解析を詳細に行った結果、いずれも遺伝子の機能を喪失する変異だった。
CSF1R遺伝子の片方のアレルの変異は、神経軸索スフェロイド形成を伴う遺伝性びまん性白質脳症(HDLS)という遅発性の神経変性疾患を引き起こすことがわかっていたが、今回、両アレルの変異がこの疾患をもたらすと新たにわかった。
ミクログリア細胞の機能不全が原因と示唆
今回、血球系の細胞の受容体として知られていたCSF1Rの機能喪失が、広範かつ多様な骨格、脳神経系の異常を持つ、新たなタイプの難病の原因となることが明らかになった。骨格の異常は、これまでに知られていた骨・関節の遺伝病の異骨硬化症、もしくはPyle病(骨幹端異形成症)に類似している。脳の異常はHDLSと同様だが、より早期に発症し、重篤で、かつHDLSでは見られない、先天的な奇形を伴っていた。
CSF1Rは、骨では骨の吸収に重要な役割を果たす破骨細胞に、中枢神経では神経細胞の機能維持・再生に重要な役割を果たすミクログリアに強く発現する。したがって、これらの細胞の機能不全が、この新しい症候群の多彩な表現型を作り出していると考えられるという。今後、患者の表現型の長期的な詳しい観察と患者検体の機能解析により、ヒトでのCSF1R遺伝子の機能、CSF1−CSF1Rシグナルの役割の解明が進展すると考えられると研究グループは述べている。
▼関連リンク
・理化学研究所 プレスリリース



