オートファジー障害モデルで脂肪酸代謝に働く仕組みを研究
順天堂大学は4月5日、オートファジーにより脂肪酸酸化(β酸化)が誘導される仕組みの解明に成功したと発表した。この研究は、順天堂大学大学院医学研究科器官・細胞生理学の小松雅明教授(新潟大学大学院医歯学総合研究科・客員教授)、生化学・細胞機能制御学の横溝岳彦教授らの研究グループによるもの。研究成果は科学雑誌「Nature Communications」に、同日付で発表された。
画像はリリースより
代表的な生活習慣病の脂質異常症(高脂血症)、動脈硬化症や脂肪肝炎などの代謝性疾患は、過剰な脂肪の蓄積が原因と言われている。一方、細胞成分を分解することで栄養素を細胞に供給するオートファジーが脂肪酸分解にも働くこと、そしてオートファジーがさまざまな生活習慣病発症を抑制することが近年明らかになりつつある。しかしながら、オートファジーが脂肪酸代謝に働く仕組みは明らかになっていなかった。そこで、研究グループはその仕組みを解明するため、オートファジー障害による脂質分子の変動を明らかにすることを目的に実験を行った。
脂肪酸酸化抑制に働くNCoR1が栄養飢餓で、オートファジー依存的に分解
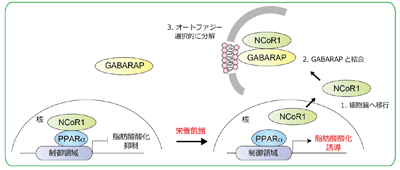
今回、研究グループは、肝臓特異的オートファジー欠損マウスを用いた詳細な生化学的、および網羅的な脂質分子解析を行った。その結果、オートファジー不全により、脂肪酸酸化を抑制する核内受容体コリプレッサー1(NCoR1)が蓄積し、その結果として脂肪酸酸化が顕著に抑制されることを発見。すなわち、NCoR1が栄養飢餓に応じて、膜構造体「オートファゴソーム」に局在するGABARAPと特異的に結合し、オートファジー依存的に分解されることを見出した。
そこで、オートファジーによるNCoR1の分解の意義を検討するため、マウスの肝臓においてオートファジー必須遺伝子Atg7を欠失させた結果、NCoR1が肝臓に過剰に蓄積し、マスター転写因子であるペルオキシソーム増殖剤活性化受容体α(PPARα)が抑制されることを確認。さらに、肝臓特異的Atg7欠損マウスは、栄養飢餓に応じた脂肪酸酸化関連遺伝子群の遺伝子発現やエネルギー源のケトン体産生を著しく低下させることも確認した。これは、栄養飢餓に応じてNCoR1がオートファジー依存的に分解されることにより効率的にPPARαが活性化し、脂肪酸酸化が促進されることを意味するという。
今回の研究から、オートファジーが単に脂質を分解するだけでなく、その分解産物である脂肪酸の代謝をも促進することで、効率的な脂質代謝を可能にしていることが判明した。一方、過剰な脂肪の蓄積が原因である生活習慣病(脂質異常症、動脈硬化症、脂肪肝炎などの代謝性疾患)において、オートファジーの抑制が指摘されており、脂質代謝の低下が強く示唆される。したがって、オートファジーの活性化がこれら生活習慣病の効率的な予防、治療を可能にできると研究グループは述べている。
▼関連リンク
・順天堂大学 プレスリリース



