長い間不明だったプロタミンのリン酸化の意義を明らかに
京都大学は3月27日、精子形態異常を伴う不妊マウスの原因を解明し、精子の成熟にプロタミン分子の脱リン酸化が重要であることを見出したと発表した。この研究は、同大大学院医学研究科の伊藤克彦准教授(現医学部附属病院准教授)、同ウイルス・再生医科学研究所の近藤玄教授、宮地均同技術専門員、福井大学学術研究院の菅井学教授、千葉大学らの共同研究グループによるもの。研究成果は、国際学術誌「Science Signaling」にオンライン掲載された。
画像はリリースより
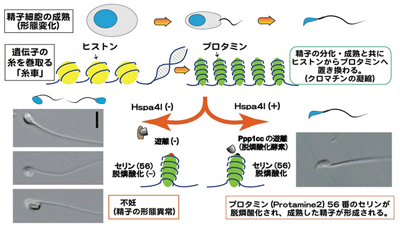
体細胞では、DNAの糸を巻き取るヒストンタンパク質が、リン酸化などの修飾を受けて機能する一方、精子細胞では、成熟に向けての形態変化の過程でヒストンがプロタミンに置き換わる。このプロタミンもヒストンと同様にリン酸化されることは知られていたが、その意義は明らかにされていなかった。
一方で、研究グループはこれまでに、哺乳動物の精子形成が体腔より低い温度で進むことに注目し、精巣に多く発現するシャペロン分子Hspa4lを見出した。シャペロン分子(群)とは、熱によって変性した細胞内の分子をホールディング(自然の状態へと折り畳む)する機能を持つもので、その大部分を熱ショックタンパク質(Hsp)が占めている。これらのシャペロンは、熱によって変性した細胞内の分子をホールディング(自然の状態へと折り畳む)する機能を持つ。Hspa41は、Hsp110 familyに属し、ホールディングや、ホールディングした分子の遊離に関わることがわかっている。
プロタミン2の56番目のセリンの脱リン酸化が精子の成熟に重要
研究グループは、自ら発見したHspa4lを欠損したマウスを作成し、その特徴を調べた。すると、精子の形態異常・不妊を示すことがわかった。この特徴は、脱リン酸化酵素(Ppp1cc)を欠損したマウスと同様であったため、両者の関係を解析した。
その結果、Ppp1ccは、Hsc70またはShp70にホールディングされて複合体となるが、Hspa4lの協調作用によって、複合体から遊離すると考えられた。また、試験管内で、Ppp1ccが組換えプロタミン2に結合し、56番目のアミノ酸(セリン)を脱リン酸化することがわかった。これにより、Hspa4l欠損マウスでは、シャペロン間(Hspa4lとHsc70)の協調作用が起こらないので、脱リン酸化酵素が遊離されず、プロタミン2の56番セリンを脱リン酸化することが出来ないために精子の形態異常や不妊を起こしたと推測出来たという。さらに詳しく解析を進めた結果、プロタミン2の56番目のアミノ酸の脱リン酸化が、精子の成熟に重要であることが判明した。
今回の研究は、修飾を受けたヒストンと同様に、プロタミンも修飾を受けて機能することを示し、ゲノム編集技法を用いてオスのマウスの不妊を治癒できることを示唆している。研究グループは、「世代を跨いで継承される精子の細胞を対象に、ゲノム編集技法を用いて変異導入することをヒトの治療に直接応用することには反対している。詳細な原因解明と、粘り強い治療研究から、ゲノムへの変異導入をしなくて良い治療方法が見出されることを期待する」と、述べている。
▼関連リンク
・京都大学 トピックス



