従来法で大きな課題となっていた「細胞内への取り込まれにくさ」
名古屋大学は3月19日、病気を治療するオリゴ核酸を細胞質内へ効率良く送達する技術を開発したと発表した。この研究は、同大大学院理学研究科の阿部洋教授、シュー・ザオマ大学院生、木村康明助教らの研究グループによるもの。研究成果は、ドイツの国際的科学雑誌「Angewandte Chemie International Edition」オンライン版に3月18日付で掲載された。
画像はリリースより
アンチセンス核酸やsiRNAによるタンパク質発現抑制法は、従来の低分子医薬品では治療が困難な疾病に対する画期的な治療法として、大きな期待を集めている。しかし、薬効分子であるオリゴ核酸分子が負電荷を多く持っているため、細胞膜を透過して細胞内に取り込まれにくいことが大きな課題だった。現在は一般的に、リポソームなどの細胞内導入法が用いられているが、細胞内移行効率が低い(オリゴ核酸が細胞内小胞に4時間以上も留まる)、毒性や分子の不均一性が見られるなど、課題が残っており、新たな手法の開発が強く求められていた。
細胞導入と機能発現が高率なうえ、毒性も観測されず
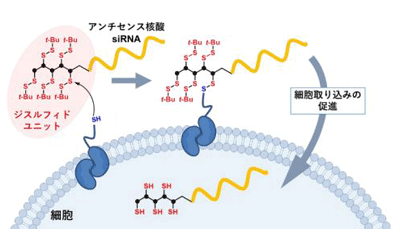
今回の研究では、オリゴ核酸分子の末端に「ジスルフィド」と呼ばれる分子構造を繰り返し導入する分子設計を行った。これは、ジスルフィド構造が細胞膜上のタンパク質が持つチオールと結合形成することで、細胞内取り込みを促進するような戦略。
研究グループはまず、ジスルフィド分子ユニットを導入したオリゴ核酸(ジスルフィド核酸)の動態を解析した。具体的には、従来法と今回の手法を用いて蛍光色素で標識したオリゴ核酸を投与し、その細胞内分布を観察した。その結果、投与から10分後、従来のリポフェクション法では、オリゴ核酸はリソソームと呼ばれる細胞小器官にとどまっているのに対し、新手法(ジスルフィド法)では大部分のオリゴ核酸が細胞質内に分布していた。すなわち、新手法を用いると、オリゴ核酸が効率よく細胞内に取り込まれるのみならず、オリゴ核酸が活性を発揮するために重要な「細胞質への移行」も非常に効率的だった。なお、従来法では1時間を経過しても大部分のオリゴ核酸はリソソームにとどまっていたことから、今回の新手法の優位性が示された。
さらに、ジスルフィドユニットを導入したオリゴ核酸は、リポフェクション法を上回る遺伝子発現抑制効果を示し、細胞毒性も観測されなかった。メカニズムに関する研究では、ジスルフィド核酸はミセルを形成していないことも判明。これは、分子組成をコントロールして投与することが可能であることを意味しており、医薬応用に向けて重要な性質である。また、細胞膜上のチオール分子と反応する試薬を投与すると、ジスルフィド核酸の細胞内取り込みが抑制されることから、設計どおりに、この分子は細胞膜上タンパク質のチオールを介して細胞内取り込みが促進されていることが示唆された。この新規の細胞内取り込み経路が、迅速な細胞質分布を可能にしていると研究グループは推定している。
▼関連リンク
・名古屋大学 プレスリリース



