摂食時の肝臓での代謝変化の意義について研究
東京大学は3月19日、絶食・摂食で大きく変化する肝臓での小胞体ストレスとそれに対する応答に注目し、Sdf2l1という分子の果たす役割を明らかにしたと発表した。この研究は、同大大学院医学系研究科分子糖尿病科学講座の笹子敬洋特任助教、同糖尿病・生活習慣病予防講座の門脇孝特任教授、国立国際医療研究センター研究所糖尿病研究センターの植木浩二郎センター長らのグループによるもの。研究成果は、「Nature Communications」に掲載されている。
画像はリリースより
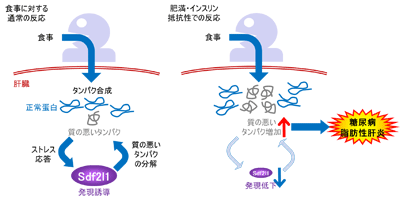
肝臓での代謝は絶食時と摂食時で大きく変化するが、その生理的意義や調節機構、またその破綻がいかに種々の疾患の病態形成に寄与するかについては、これまで十分解明されていなかった。
Sdf2l1やその発現量が治療標的やバイオマーカーになる可能性
研究グループはまず、マウスの実験で、摂食により肝臓で小胞体ストレスが一時的に惹起されることを見出した。さらに詳しく調べたところ、複数の小胞体ストレス関連遺伝子の中でも、特に「Sdf2l1」という遺伝子の発現が大きく上昇していた。Sdf2l1は小胞体ストレスに応答して転写が誘導される。そこで、その発現を低下させてみると、小胞体ストレスが過剰となり、インスリンの効きが悪くなるインスリン抵抗性や脂肪肝が生じた。
また、肥満・糖尿病のモデルマウスではSdf2l1の発現誘導が低下していたが、発現を補充するとインスリン抵抗性や脂肪肝が改善。加えて、ヒトの糖尿病症例の肝臓において、Sdf2l1の発現誘導がインスリン抵抗性や脂肪性肝炎の病期の進行と相関することが示された。
これらの結果から、摂食に伴う小胞体ストレスに対する適切な応答が重要であるとともに、その応答不全が糖尿病・脂肪性肝炎の原因となることが明らかになった。今後は、Sdf2l1やその発現量が、糖尿病・脂肪性肝炎の治療標的やバイオマーカーとなることが期待される。研究グループは、「元はマウスでの検討から始まった研究だが、目の前の患者の病態解明につながる結果も、得ることができたように思う」と、述べている。
▼関連リンク
・東京大学 UTokyo FOCUS



