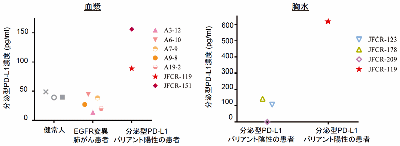
RNAスプライシングの異常により、約20%に分泌型バリアントが出現
日本医療研究開発機構(AMED)と、がん研究会は3月14日、抗PD-L1抗体薬治療に対して獲得耐性となった17症例について網羅的な遺伝子解析を行ったところ、4症例(約20%)において、治療標的にあたるPD-L1タンパク質でRNAスプライシングの異常により分泌型バリアントが出現することを発見したと発表した。この研究は、がん研究会がん化学療法センター 基礎研究部の片山量平部長、東京大学大学院新領域創成科学研究科の龔博大学院博士課程らを中心とする研究グループによるもの。研究成果は「Journal of Experimental Medicine」に掲載されている。
画像はリリースより
免疫チェックポイント阻害薬は、これまでの化学療法や分子標的療法ではあまり見られなかった2~3年を超える長期奏効例が、一部の患者で観察されている一方で、治療耐性となり腫瘍が再増悪する(獲得耐性)症例も多く観察され始めている。これまでの免疫チェックポイント阻害薬に対する治療耐性の研究は、ニボルマブをはじめとする抗PD-1抗体薬を対象としたものが多く、免疫細胞ががんを攻撃する目印となる抗原提示が消失してしまうといったメカニズムなどが明らかにされてきた。しかし、抗PD-L1抗体薬に対する治療耐性メカニズムについては、ほとんど明らかになっていなかった。
分泌型PD-L1バリアントが抗PD-L1抗体薬の活性を競合的に中和
研究グループは、抗PD-L1抗体薬治療に対して獲得耐性となった17症例について網羅的な遺伝子解析を行ったところ、4症例(約20%)において、治療標的にあたるPD-L1タンパク質でRNAスプライシングの異常により、分泌型バリアントが出現することを発見。また、分泌型PD-L1バリアントの機能を検証するため、京都大学ウィルス・再生医科学研究所再生免疫学分野の河本宏教授らの研究グループとの共同研究により、ヒトT-iPS細胞(iPS細胞より再生した腫瘍を特異的に認識するキラーT細胞)を用いた実験系を利用し、分泌型PD-L1バリアントが抗PD-L1抗体薬の活性を競合的に中和し、T細胞の再活性化を抑制することを証明した。
さらに、実験動物を用いたin vivoモデルにて、分泌型PD-L1バリアントを発現する細胞が、がん全体のわずか1%の頻度で存在するだけで分泌型PD-L1が腫瘍組織内および生体内に蓄積され、抗PD-L1抗体薬の治療耐性を誘導することを示した。また、抗PD-1抗体薬が分泌型PD-L1バリアントによる治療耐性を克服できる可能性を示すことにも成功した。
今回の研究により、抗PD-L1抗体薬の耐性機構として分泌型PD-L1バリアントの存在が示された。今後、血液など体液を用いた分泌型PD-L1のモニタリングが、治療効果予測に有益な情報を与える可能性があるという。また、分泌型PD-L1バリアントによる治療耐性は、抗PD-1抗体薬により克服できる可能性も明らかとなり、分子メカニズムに合わせた免疫チェックポイント阻害薬の治療に貢献できることが期待されると、研究グループは述べている。
▼関連リンク
・日本医療研究開発機構(AMED) プレスリリース




