免疫療法でT細胞の「疲弊」が起きる
慶應義塾大学は2月28日、マウスモデルを用いて、腫瘍内の免疫細胞(T細胞)を疲弊化する分子メカニズムを解明し、疲弊した免疫を回復させることでより効果的ながん治療へ応用できることを証明したと発表した。この研究は、同大医学部微生物学・免疫学教室の吉村昭彦教授と、米ラホヤ免疫アレルギー研究所のAnjana Rao教授らの共同研究グループによるもの。研究成果は、英科学雑誌「Nature」のオンライン速報版に2月27日付で公開された。
画像はリリースより
近年、オプジーボ(抗PD-1抗体)などの「免疫チェックポイント阻害剤」が、ある種のがん治療に有効であるとして注目されている。また、がん患者の腫瘍組織などから分離したがんに特異的なT細胞を試験管内で大量培養し、患者へ再び戻す「細胞移入療法」も有用な治療法と考えられている。しかしながら、がん組織や試験管内で何度も刺激を受けることで、T細胞は「疲弊」と呼ばれる機能不全状態に陥ってしまう。
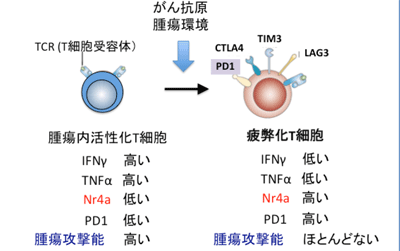
疲弊したT細胞の特徴は、PD-1やTim3といったT細胞の活性化を抑制する複数のチェックポイント分子を細胞表面に高度に発現することと、インターフェロン(IFN)γや腫瘍壊死因子(TNF)αといった抗腫瘍性サイトカインの産生が低下すること。一旦疲弊状態に陥ったT細胞は、患者体内に戻してもがん細胞を攻撃する力が弱く、十分な治療効果を得ることができない。これが、がん免疫療法の治療効果を減弱させる要因の1つと考えられているが、これまで「T細胞の疲弊化」を生み出す分子メカニズムは不明だった。
転写因子「Nr4a」が疲弊化に極めて重要
今回研究グループは、マウス腫瘍モデルを用いて、腫瘍内で疲弊化したT細胞に特徴的な遺伝子の発現調節領域の性質を解析。その結果、疲弊化T細胞で発現が上昇する多くの遺伝子の調節領域には、「Nr4a」という転写因子の結合配列が認められることが判明した。特にPD-1遺伝子では、上流のエンハンサー領域にNr4aが結合し、PD-1の発現を増大して安定化させるとわかった。Nr4aには3つの類似遺伝子があり、どれも似た機能を持つが、今回、腫瘍に集積する疲弊化したT細胞では、この3つすべての遺伝子発現が高まっていた。また、刺激を受けていないT細胞にそれぞれのNr4a遺伝子を強制的に発現させたところ、疲弊したT細胞に似た特徴的な変化が誘導された。
次に3つのNr4a遺伝子をすべて欠損するT細胞を用いて腫瘍マウスへの細胞移入実験を行った。細胞表面マーカーで評価したところ、通常のT細胞は腫瘍内で50%以上が疲弊化したが、Nr4a遺伝子をすべて欠損するT細胞では疲弊化したのは20%程度だった。T細胞移入療法として、腫瘍に特異的なT細胞を腫瘍モデルマウスに投与すると、通常のT細胞でも若干の腫瘍の退縮効果はみられるものの、投与90日後には全例死亡した。一方、Nr4a遺伝子欠損T細胞では、腫瘍の退縮効果が強く、投与90日後でも70%以上のマウスが生存していた。すなわちNr4aがT細胞の「疲弊」にとって極めて重要な遺伝子であることと、これを取り除くことで強力な抗がん作用が得られることがわかった。
Nr4a阻害剤は新たながん治療薬になり得る
研究グループは先行研究で、Nr4a遺伝子が制御性T細胞を生み出す重要な遺伝子であることを報告しており、さらに、Nr4aの活性を抑制する薬剤のスクリーニングにより、抗がん剤のカンプトテシン(CPT-11、イリノテカン)がNr4aの転写活性を阻害することを発見、マウス腫瘍モデルでカンプトテシンが腫瘍攻撃性のT細胞を増やし腫瘍保護的な抑制性T細胞を減少させることも報告している。また、別のグループからはカンプトテシンと免疫チェックポイント阻害剤を併用すると抗がん効果が増強されることが報告されている。これらの結果から、Nr4aを標的とする阻害剤はがん治療の新たな標的になり得ることが示されている。
研究グループは、「次の課題は、実際にヒト腫瘍内のT細胞で同様の機構が認められるか、Nr4a阻害剤がヒト腫瘍でも効果があるかを確かめること」だとしている。
▼関連リンク
・慶應義塾大学 プレスリリース



