ダイナミックに遺伝子発現調節を行うスーパーエンハンサーに着目
名古屋大学は2月27日、DNA結合性タンパク質「RET finger protein(RFP)」の働きを抑えることで、悪性脳腫瘍である膠芽腫に対する化学療法の効き目が改善することを示し、さらに次世代シーケンサーを用いた解析でそのメカニズムを明らかにしたと発表した。この研究は、同大大学院医学系研究科脳神経外科学の夏目敦至准教授、Melissa Ranjit研究員、平野雅規研究員、同腫瘍病理学の榎本篤准教授、高橋雅英教授、北里大学医学部病理学の加藤琢哉助教らの研究グループによるもの。研究成果は「Cell Reports」に掲載されている。
画像はリリースより
脳腫瘍はWHOの定める定義に基づき、難治性に応じてGradeI~IVに分類されるが、膠芽腫は最も治療の見通しが悪いGradeIVの代表的な疾患。膠芽腫を難治にしている要因のひとつに、現在、唯一明確な効果が示されている化学療法薬(テモゾロミド:TMZ)に対する耐性が生じることが挙げられており、メカニズムの解明・克服が喫緊の課題となっている。
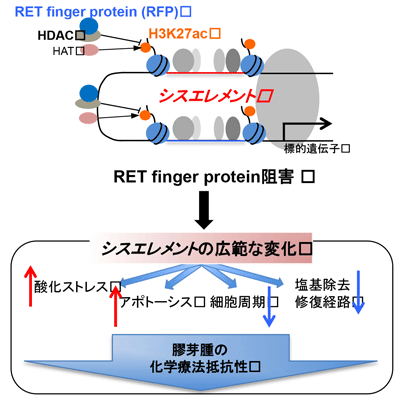
遺伝子の発現を調整するエピゲノム機構の異常は悪性腫瘍の発生や性質に大きな影響を与えることが報告されてきている。研究グループは、その中でも特にダイナミックに遺伝子発現調節を行うスーパーエンハンサーに着目。スーパーエンハンサーを含むシスエレメントは、ヒストン脱アセチル化酵素(HDAC)による調整を受けており、ヒストンH3の27番目のアミノ酸であるリジンがアセチル化される修飾(H3K27ac)が指標となる。このHDACと相互作用する適切な分子をターゲットとすることで、腫瘍に特異的な形質獲得のメカニズム解明および新規治療法の開発につながる可能性が考えられるという。
RFP阻害によるTMZ抵抗性改善のメカニズムを検討
研究では、HDACと相互作用する候補分子として報告されているRET finger protein(RFP)を選定し、さまざまな検討を行った。その結果、テモゾロミド抵抗性の高い脳腫瘍においてRFPが多く発現していることが判明。また、細胞・マウスモデルの両方で 、RFP 阻害によりTMZ 抵抗性が大幅に改善されることが示された。
さらに、RFP阻害によるTMZ抵抗性改善のメカニズムを検討するため、次世代シーケンサーを用いた解析(遺伝子発現解析・クロマチン免疫沈降シーケンス解析)を行ったところ、RFP阻害により、広範なヒストン修飾(H3K27ac)の変化が起き、それに伴い近傍の遺伝子発現も変化していることが明らかとなった。酸化ストレスやアポトーシスに関連する遺伝子が活性化される一方、細胞分裂やDNA修復を促進し、化学療法を効かないようにする遺伝子群が不活化されており、これらが治療効果に寄与していると考えられるという。
今回着目したRFPは、脳腫瘍の悪性化・化学療法抵抗性獲得に関連する複数の経路を調整する役割を果たしており、今後、これをターゲットとした新規脳腫瘍治療薬の開発が期待される。さらに今回用いた実験手法により、他の有望な治療ターゲット分子を探索し、治療薬選択の幅を増やしていくことが期待される。
▼関連リンク
・名古屋大学 プレスリリース



