好塩基球とマスト細胞の違いに関わる分子を見つける
北海道大学は2月19日、アダプター分子であるSTAP-2が、IgEに依存する刺激を受けた際にアレルギー炎症反応(好塩基球活性化応答)を増強させるという新たな機能を見出したと発表した。この研究は、同大学大学院薬学研究院の柏倉淳一講師、松田正教授らの研究グループによるもの。研究成果は、「International Immunology」誌に2月6日付で公開された。
画像はリリースより
アレルギー反応において、IgEと細胞を接続する役目を果たす高親和性IgE受容体(FcεRI)は、好塩基球とマスト細胞の両方の表面に発現している。好塩基球とマスト細胞は異なる機能をもつことが報告されているが、その違いがどのようなメカニズムで、どの分子により決定されるかは、これまで解明されていなかった。
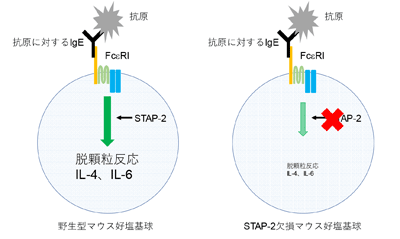
Signal-Transducing Adaptor Protein-2(STAP-2)は,柏倉講師らの研究室が同定したアダプター分子で、これまでの研究でSTAP-2が「マスト細胞」ではFcεRIを介した活性化を「減らす」分子であることが明らかとなっている。一方,同じ受容体を発現する「好塩基球」に対するSTAP-2の働きは解明されておらず、アレルギー疾患の新規治療薬開発を進めるためには好塩基球活性化応答に対するSTAP-2の機能を調べる必要があった。
STAP-2はFcεRIを介した好塩基球の活性化を調節
そこで今回研究グループは、好塩基球への分化及びFcεRIを介した活性化反応に対するSTAP-2の機能を調べた。まず、野生型とSTAP-2欠損マウス間で生体内での好塩基球数を調べたところ、両群ともに同程度だった。また、血中の好塩基球細胞表面上のFcεRI発現も、両群で相違がみられなかった。さらに、両マウスの骨髄細胞からIL-3存在下で骨髄由来培養好塩基球(BMB)を誘導し、発現分子等を詳しく比較解析した結果、STAP-2は好塩基球の分化には影響を与えないと分かった。
次に、FcεRIを介した好塩基球活性化反応に対するSTAP-2の機能を調べるために、野生型およびSTAP-2欠損マウス由来のBMBを用いて解析した。その結果、FcεRI依存性好塩基球脱顆粒反応がSTAP-2欠損BMBで有意に低下していた。また、好塩基球活性化の指標となるIL-4やIL-6産生量も、STAP-2 欠損 BMBで減少が観察された。以上から、STAP-2は「好塩基球活性化応答を増加させる」ことが示された。さらに分子機構の解析を進めたところ、FcεRI受容体直下のチロシンリン酸化酵素Lynの活性化及びその下流シグナル分子PLC- 2のリン酸化反応がSTAP-2欠損BMBで有意に弱まっていることが観察された。最後に生体内での好塩基球活性化反応におけるSTAP-2の機能を調べたところ、STAP-2欠損マウスではFcεRI依存性好塩基球活性化反応が野生型マウスと比較して有意に抑制されていることが見られた。以上の結果から、STAP-2は好塩基球においてFcεRIを介したシグナル伝達に関与することで、好塩基球活性化反応を調節する分子であると判明した。
今回の研究により、マスト細胞と好塩基球との機能の違いにSTAP-2が関与していることがわかった。また、好塩基球に依存したアレルギー反応ではSTAP-2を標的とした新規アレルギー治療薬が有効である可能性が示唆された。今後、STAP-2を標的とした新規治療薬の開発が進むことが期待されると研究グループは述べている。
▼関連リンク
・北海道大学 プレスリリース




