現行のHbA1c酵素測定法は「2 ステップ」
京都大学は1月31日、糖尿病診断マーカーである「ヘモグロビンA1c(HbA1c)」臨床検査試薬に応用が可能な改変酵素「HbA1c ダイレクトオキシダーゼ(HbA1cOX)」の創製に成功したと発表した。この研究は、同大学大学院農学研究科の橋本渉教授、摂南大学の村田幸作教授、協和メデックス株式会社らの研究グループによるもの。研究成果は、国際学術誌「Scientific Reports」に1月30日付でオンライン掲載された。
画像はリリースより
臨床検査において、さまざまなHbA1c測定試薬が開発、使用されているが、近年開発された「HbA1c酵素測定法」は抗体を用いる方法に比べて、安価かつ扱いやすいという特長があり、普及が進んでいる。現行のHbA1c酵素測定法は、糖化ペプチドオキシダーゼ(FPOX)を主要な酵素として使用するが、FPOXは大きな分子であるHbA1cと直接反応できない。そのため、前処理としてタンパク質分解酵素でHbA1cの分解処理を行い、生成されたF-VH(フルクトシルバリルヒスチジン)を測定することにより、間接的にHbA1cを測定する(2ステップ法)。一方、タンパク質分解酵素を用いない「1ステップ法」はより簡便な測定法となることが期待されるが、直接HbA1c分子に作用する酵素が自然に見つからない、あるいは作ることができないことから、実現してなかった。
創製した酵素「AnFPOX-47」で1ステップ測定が可能に
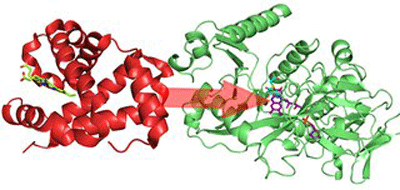
今回研究グループは、協和メデックスが保有する酵素「AnFPOX-15」の構造を改変させることにより、直接HbA1cに作用する酵素「HbA1cOX」を創製し、HbA1cの1ステップ酵素測定法を開発することを目的とした研究を実施した。AnFPOX-15は本来、直接HbA1cに作用することが出来ない酵素。構造改変の手がかりを得るためにAnFPOX-15のX線結晶構造解析を行ったところ、AnFPOX-15の活性部位の入口が、大きな分子であるHbA1cにとって狭すぎて直接反応できないことが予想された。そこで、活性部位の入口を形成するアミノ酸(R61:61位アルギニン)を、人工的に、より小さなアミノ酸(G61:61位グリシン)に置き換えて、入り口を拡張するように構造を改変したところ、HbA1cへの反応性のきっかけとなる新たな反応性が得られることがわかったという。
そこからさらにランダム変異(分子進化的手法)を織り交ぜて改変を進め、反応性を段階的かつ飛躍的に上昇させた。最終的にAnFPOX-15を構成するアミノ酸のうち10個を置き換えることによって、改変酵素「AnFPOX-47」を取得。このAnFPOX-47が、タンパク質分解酵素を用いなくてもHbA1cと直接反応できる酵素、即ちHbA1cOXであると、世界で初めて実験的に証明することに成功した。そこで、AnFPOX-47を使用してHbA1cの測定試薬を試作したところ、臨床の場で使用されている既存のHPLC(高速液体クロマトグラフィー)による測定法と良好な相関が得られることがわかり、新しい測定法として機能し得ることが示された。
現在、創製したHbA1cOX(AnFPOX-47)を用いて実用的なHbA1c測定試薬(臨床検査薬)の開発を進めている。今後は、世界的な要求に応えるべく開発を推進し、一日も早く実用化したい、と研究グループは述べている。
▼関連リンク
・京都大学 研究成果



