細胞増殖に関わる遺伝子から転写されるmRNAに多いARE-mRNA
北海道大学は12月26日、がん細胞などの中にAU-rich element(ARE)と呼ばれる分解シグナルを持つmRNAが安定して存在していることを利用し、がんなどの腫瘍を溶解させるアデノウイルスの開発に成功したと発表した。この研究は、同大大学院歯学研究院の東野史裕准教授らの研究グループによるもの。研究成果は、Oncology Reports誌に掲載された。
画像はリリースより
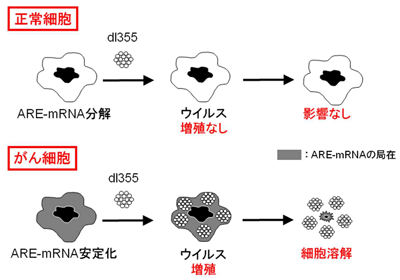
AREは、mRNAの分解シグナルで、ARE-mRNAは通常転写後すぐに分解される。ARE-mRNAは、がん原遺伝子など細胞の増殖に関わる遺伝子から転写されるmRNAに多い。何らかの原因で安定化システムに異常が起こり、ARE-mRNAが恒常的に安定化されると、発がんや炎症などさまざまな疾患に関わることが知られている。
研究グループはこれまでに、がん細胞などではARE-mRNAが恒常的に核外輸送・安定化されていることを解明。さらに、ARE-mRNAの安定化がアデノウイルスの増殖にも必要であることを突き止め、この安定化にはウイルス遺伝子産物E4orf6が必須であることも見出した。これらの成果から、E4orf6を欠失したアデノウイルス「dl355」は、ARE-mRNAがあらかじめ安定化されているがん細胞では増殖し、最終的には細胞を溶解する。一方、正常細胞ではE4orf6がないためあまり増殖できず、細胞に影響を与えないことが期待されている。このような背景から、E4orf6欠失アデノウイルスを、腫瘍溶解アデノウイルスとして開発したという。
がん細胞と正常細胞にdl355を感染させ、ウイルス増殖を検討
今回の研究では、HeLa、C33A、A549、H1299などのがん細胞とBJ細胞などの正常細胞に、dl355を感染させてウイルス増殖を検討。その結果、がん細胞の方が正常細胞と比べて1,000~10,000倍程度ウイルス生産量が高くなった。同様の細胞に、dl355をMOI(細胞1個に感染させるウイルスの数)を変えて感染させ、約1週間後の生細胞を染色したところ、がん細胞では感染させるdl355のMOIが高くなるほど細胞死が見られ、正常細胞では細胞死がほとんど起こらなかったという。
次に、ヌードマウスの皮下にHeLa細胞を移植して腫瘍を形成。dl355を腫瘍に直接投与して腫瘍の縮小を観察したところ、dl355投与群では腫瘍の縮小が見られ、dl355は動物実験でも効果があることが判明した。さらに、中国で臨床応用されている腫瘍溶解ウイルスと同等のウイルスと、dl355の持つ腫瘍溶解効果を比較すると、dl355の効果の方が高いことも見出した。これらの結果から、dl355は腫瘍溶解ウイルスとして十分な能力を持つことが明らかになったとしている。
ARE-mRNAの核外輸送・安定化は、がん特有の現象ではなく、炎症性疾患やウイルス性疾患など、さまざまな疾患の細胞で見られる。研究グループは、「dl355感染による細胞溶解を治療法として確立できれば、どのような疾患にも利用できる可能性がある。今後、さまざまな疾患に対する新たな治療法『ウイルス療法』の開発が期待できる」と、述べている。
▼関連リンク
・北海道大学 プレスリリース



