最も予後不良なサブタイプとして報告されるKDM6A不活化
東京医科歯科大学は12月18日、予後不良な膵がんサブタイプにおけるヒストン修飾遺伝子「KDM6A」の不活化が、がん悪性化を起こす機序を世界で初めて明らかにした発表した。この研究は、同大大学院医歯学総合研究科分子腫瘍医学分野の田中真二教授、島田周助教、秋山好光講師、渡辺秀一大学院生の研究グループと、同ウイルス制御学の山岡昇司教授、同肝胆膵外科学の田邉稔教授との共同研究によるもの。研究成果は、国際科学誌「International Journal of Cancer」オンライン版にて公開された。
画像はリリースより
近年、がんのサブタイプに応じた治療の最適化がさまざまながん腫で進められている。しかし、典型的な難治性がんのひとつである膵がんでは、確立されていない。
近年、国際共同プロジェクトによる大規模統合解析の結果をもとに、膵がんにおけるサブタイプ分類が提唱され、最も予後不良なサブタイプの特徴としてKDM6A不活化変異が報告されている。KDM6Aはヒストン修飾因子のひとつで、ヒストンアセチル化酵素p300と複合体を形成して遺伝子の発現を制御することが報告されているが、ヒト膵がんにおける臨床的意義や機能については不明だった。
HDAC阻害剤の投与でCDKN1A発現上昇と腫瘍抑制を確認
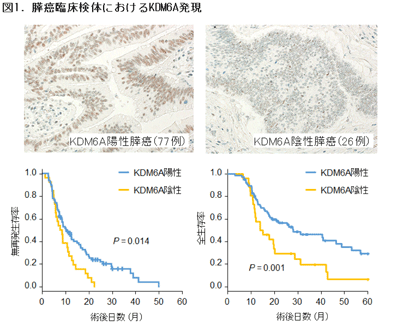
今回の研究では、Cancer Genome Atlas Networkにより公共データベースに登録された膵がん147症例を再解析。既報(Collisson et al. Nat Med 2011)と同様に、膵がんが3つのサブタイプに分類されることを確認した。その際、予後不良なサブタイプは全体の30%を占め、これらの症例では、KDM6Aの発現低下とともにKDM6Aのアレル欠失が集積していたという。また、ヒト膵がんの臨床症例を解析したところ、全症例の25%でKDM6Aが発現しない(陰性)症例がみとめられ、これらは有意に予後不良であることを見出した。
次に、ヒト膵がん細胞でKDM6A発現を操作した細胞株を作成。KDM6Aをノックアウトした膵がん細胞では増殖能、遊走能、浸潤能および造腫瘍能が亢進した一方、KDM6Aを強制発現すると、それらが低下したという。さらに、KDM6Aとヒストンアセチル化酵素p300の共局在と相互作用が示され、ヒストンH3リジン27のアセチル化(H3K27ac)を促すことが示唆された。
また、KDM6Aノックアウト膵がん細胞株では、CDKN1Aをはじめとするがん抑制因子群の遺伝子発現が抑制。CDKN1A遺伝子について解析を行ったところ、プロモーター領域でH3K27acが低下していた一方で、強制発現株ではH3K27acの上昇および発現亢進がみとめた。そこでヒストン脱アセチル化酵素(HDAC)阻害薬を投与したところ、KDM6Aノックアウト株では、薬剤感受性が有意に亢進しており、CDKN1Aのプロモーター領域でのH3K27acの回復と発現上昇をみとめたという。また、KDM6Aノックアウト膵がんの移植腫瘍モデルでは、HDAC阻害剤投与によりCDKN1A発現上昇と腫瘍抑制をみとめた。
これらの結果から、KDM6A不活化がヒストンアセチル化酵素p300との複合体形成不全からがん抑制遺伝子のプロモーター領域におけるヒストンアセチル化の低下と発現低下をきたし、がんの悪性化にいたるという機序が判明。KDM6A不活化膵がんサブタイプの特異的治療として、HDAC阻害薬を用いた治療の有効性が示唆された。研究グループは、「今後、サブタイプを考慮した臨床試験の構築などを通して難治がんである膵がんに対して新たな治療戦略が開発されることが期待される」と述べている。
▼関連リンク
・東京医科歯科大学 プレス通知資料




