不明だったSEAMの発生におけるラミニンの役割
大阪大学は12月5日、iPS細胞からさまざまな異なる眼の細胞へ選択的に分化誘導することに成功したと発表した。この研究は、同大大学院医学系研究科の林竜平寄附講座教授(幹細胞応用医学寄附講座)、西田幸二教授(眼科学)、柴田峻共同研究員(ロート製薬、眼科学)らの研究グループが、同蛋白質研究所の関口清俊寄附研究部門教授らと共同で行ったもの。研究成果は米科学雑誌「Cell Reports」に11月6日に掲載された。
画像はリリースより
iPS細胞は、無限に増殖し、人間の身体を構成するさまざまな細胞に分化することができることから、再生医療や創薬研究、発生研究に非常に有用な細胞だ。研究グループはこれまでに、ヒトiPS細胞から眼全体の発生を模倣した2次元培養系を用いて、さまざまな眼の細胞を含む多層状コロニー(SEAM)を誘導し、さらに、機能的な角膜上皮組織(iPS角膜上皮シート)を作製することに成功している。iPS角膜上皮シート移植は、外傷や病気により、角膜上皮の幹細胞が失われた難治性角膜疾患に対する新たな再生医療として期待されている。
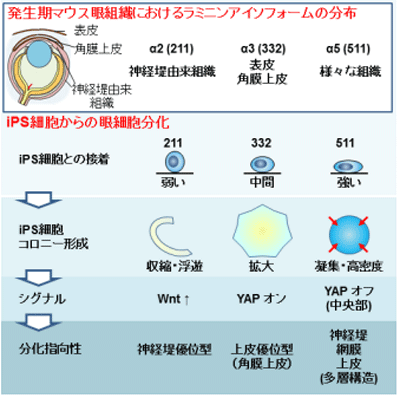
iPS細胞がどのような細胞になるかという運命決定において、成長因子などを含む培養液と同様に、細胞の足場となる基質も重要な役割を果たすことが近年報告されている。眼全体の発生を模倣したSEAMは、神経、神経提、網膜、角膜等で構成されており、細胞の足場となる基質、基底膜タンパク質のラミニン上で、iPS細胞から自律的に発生する。しかし、SEAMの発生におけるラミニンの役割はわかっていなかった。
ラミニンのアイソフォームが眼の細胞への運命決定に寄与
今回、研究グループは、足場がiPS細胞の分化に与える影響について着目。ラミニン211を基質としてiPS細胞を培養・分化させると、神経堤細胞が多く誘導された。その際に、Wntシグナルパスウェイに関連する遺伝子やWntシグナルの標的となる遺伝子(AXIN2、LEF1)の発現が上昇しており、神経堤細胞の分化過程でWntシグナルが活性化していることが明らかになった。次に、ラミニン332を基質とすると、角膜上皮細胞が多く誘導。ラミニン332上で誘導し作製したiPS角膜上皮細胞シートでは、角膜上皮細胞のマーカー(PAX6,KRT12,MUC16,p63)が発現していることを確認した。ラミニン511では、iPS細胞が網膜・角膜を含む多層構造へ分化することが先行研究で明らかとなっていたことから、培養皿のコーティングに用いるラミニンのアイソフォームが、iPS細胞の眼の細胞への運命決定に寄与していることを新たに解明したとしている。
また、ラミニン511を用いて培養すると、iPS細胞は高度に凝集。コロニー内の細胞におけるYAPの局在を観察すると、凝集している中央部では、YAPが細胞質に局在していた。これにより、中央部では高い細胞密度によってYAPシグナルがOFFになることが示された。この中央部では、神経外胚葉マーカーのN-カドヘリン陽性細胞が分化。一方、コロニーの周縁部では、YAPは核に局在し、YAPのシグナルがONになっていたという。この周縁部では、表面外胚葉のマーカーのE-カドヘリン陽性細胞が分化していた。これらの結果から、ラミニン511を用いたiPS細胞のSEAMへの分化には、細胞密度によって制御されるYAPシグナルが関連していることが示唆された。
今回の研究成果により、目的の眼組織で発現するラミニンのアイソフォームを、iPS細胞からの眼細胞分化誘導に用いることで、その組織の誘導を促進する可能性が示唆された。研究グループは、「本研究を応用することで、iPS細胞の足場による運命決定制御や眼の発生機序の解明、角膜再生医療実用化に向けたiPS角膜上皮細胞の作製効率化が期待される」と述べている。
▼関連リンク
・大阪大学 研究情報



