多くのアトピー性皮膚炎でフィラグリン発現の低下が観察
京都大学は11月16日、ヒト表皮細胞において、皮膚バリア機能・保湿機能を担うフィラグリンの発現を誘導する内因性物質として、リゾホスファチジン酸(LPA)を同定したと発表した。この研究は、同大大学院医学研究科創薬医学講座の成宮周特任教授(京都大学名誉教授)、タムケオ・ディーン特定准教授、住友明子特定研究員(現:トロント大学薬物依存・精神衛生センター博士研究員)らの研究グループによるもの。研究成果は「Journal of Investigative Dermatology」に掲載されている。
画像はリリースより
皮膚の主な機能は外部環境からの病原体やアレルゲン、その他の有害物質の侵入を防ぐとともに、生体内部からの水分蒸発を最小限にするバリア機能であり、フィラグリンはそのバリア機能に重要な役割を果たしている。フィラグリンは、表皮の顆粒細胞で産生される塩基性タンパク質の一種で、ケラチンとの重合により皮膚の角質層において重要なバリア構造体を形成するとともに、角質上層において最終的にアミノ酸などの低分子まで分解されることにより、皮膚の保湿機能を担うことがわかっている。
近年、フィラグリン遺伝子の変異が皮膚バリア機能の破綻をもたらしアトピー性皮膚炎発症につながること、また、アトピー性皮膚炎の多くの症例においてフィラグリン発現の低下が観察されることが報告され、フィラグリン発現の促進によるアトピー性皮膚炎の発症予防と治療の可能性が示唆されてきた。しかし、フィラグリンの詳細な発現制御メカニズムに関する知見は乏しく、フィラグリンの発現を活性化する内因性物質は明らかにされていなかった。
リゾホスファチジン酸の塗布で皮膚保湿機能が改善
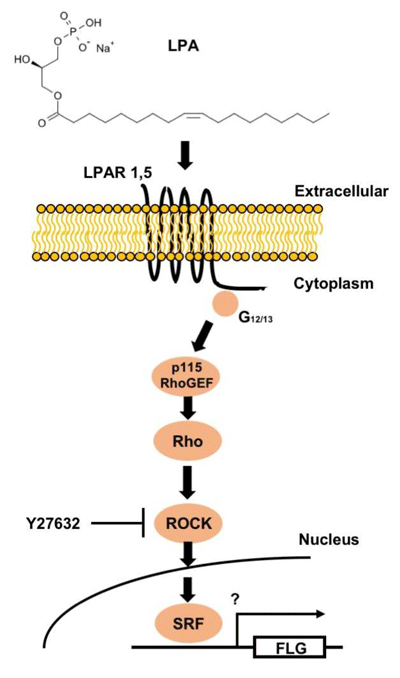
研究グループは今回、ヒト表皮細胞でのフィラグリン発現の発現促進物質の同定と、その物質の働く分子メカニズムの解明を試みた。最初にヒト新生児皮膚から採取した表皮細胞を用いて、フィラグリン遺伝子発現誘導を安定的に定量できる実験条件を確立。さらに、GPCRアレイを用いた細胞内シグナル伝達に関与する受容体遺伝子発現の網羅的スクリーニングを行った結果、ヒト角化細胞に高発現するGタンパク共役型受容体(GPCR)を同定し、そのうちのひとつであるEDG2/LPAR1受容体のリガンドであるリゾホスファチジン酸(LPA)に濃度依存的なフィラグリン遺伝子発現誘導活性を見出した。また、各種LPA受容体の特異的アゴニスト・アンタゴニスト、さらにRNAiによる発現ノックダウンの手法を用いて、LPAR1とLPAR5の2種類の受容体がヒト表皮細胞におけるLPA依存性のフィラグリン発現誘導に不可欠であることを見出した。
これら受容体には、G12/13タンパクが共役して下流のRho-ROCK-SRFシグナル伝達経路を介してフィラグリン発現誘導を行うことも合わせて確認。加えて、ヒト表皮細胞におけるLPAの機能を明らかにするため、マイクロアレイを用いた網羅的遺伝子発現解析を行った結果、LPAにはヒト表皮細胞の分化を促進する遺伝子群を広範に誘導する作用があることが明らかになった。最後に、皮膚バリア機能の低下した状態において、LPAがフィラグリンをはじめとする角質細胞分化促進因子を誘導してバリア機能の改善を行うことができるかどうかを、マウスの皮膚バリア機能低下モデルを用いて検証したところ、LPAを皮膚に塗布することにより皮膚保湿機能が改善され、バリア機能が向上することが示唆されたとしている。
近年、アトピー性皮膚炎において炎症性サイトカインの上昇が報告され、免疫抑制作用のある薬剤(JAK阻害剤)で炎症反応を低下させる治療法が開発されたが、今回の研究では、LPAの作用はフィラグリンおよび皮膚バリア機能関連分子群の発現を強力に誘導し、炎症によって障害を受けた皮膚バリア機能を改善させることが判明した。LPAは内在性の生理活性脂質であることから、アトピー性皮膚炎や、乾癬も含めた皮膚のバリア機能低下を呈する疾患において、副作用の少ない、より効果的な治療戦略となる可能性がある。研究グループは、「各種病態において、LPAとその下流のシグナル伝達経路がどのように変化しているかを今後詳細に解析することにより、研究成果が皮膚疾患における新たな治療法の開発の糸口となることを期待している」と述べている。
▼関連リンク
・京都大学 研究成果




