Luminal A乳がんでも20%程度の患者は予後不良
東京大学は11月13日、Fbxo22という分子が、エストロゲン受容体陽性乳がんに対して抗エストロゲン剤の効果を左右し、予後の決定に重要な役割を果たしていることを明らかにしたと発表した。この研究は、同大医科学研究所癌細胞増殖部門癌防御シグナル分野の中西真教授、城村由和助教、聖マリアンナ医科大学大学院医学研究科応用分子腫瘍学の太田智彦らの研究グループによるもの。研究成果は「Journal of Clinical Investigation」に掲載されている。
画像はリリースより
一般的に、女性ホルモン受容体(エストロゲン受容体)を持ち、かつ増殖因子受容体を持たない乳がん(Luminal A乳がん)は、乳がん細胞の増殖が女性ホルモンであるエストロゲンに応答していることから、タモキシフェンをはじめとした抗エストロゲン剤(SERM)投与が有効であり、比較的治療効果が高く予後の良い乳がんとされている。しかし、約20%程度のエストロゲン受容体陽性乳がんは、抗エストロゲン剤の効果が低く予後の悪い高リスクな症例で、それを鑑別する方法や、なぜ抗エストロゲン剤が作用しないのかについては、明らかにされていない。
これらの問題を解決すべく遺伝子発現解析のアルゴリズムを利用した高リスク群予測マーカーが開発されているが、有用性はまだ確立しておらず、検査費用が高額である上に結果が出るまでの所要時間も長く、臨床応用するには多くの問題を抱えている。そのため、安価かつ信頼性の高い診断法の開発が急務となっている。
Fbxo22タンパク質の低下が乳がんの再発や予後と強く相関
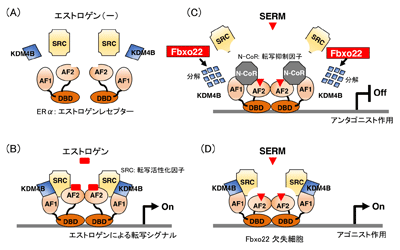
乳がんの治療に用いられるタモキシフェンなどの抗エストロゲン剤が機能し、治療効果を発揮するためには、エストロゲン受容体に結合した活性化因子が解離し、抑制化因子に変換される必要がある。研究チームは、この解離と変換に、エストロゲン受容体に結合したタンパク質「KDM4B」がFbxo22によりユビキチン化され、分解されることが必要であることを発見した。
エストロゲン受容体には、DNAに結合する領域(DBD)と活性化因子(SRC)や抑制化因子(N-CoR)に結合するAF-1およびAF-2と呼ばれる領域がある。エストロゲンは、AF-2領域と活性化因子との結合を促進する。この状態で抗エストロゲン剤(SERM)を加えると、AF-2領域から活性化因子が解離し、さらにAF-1領域と結合していたKDM4BがFbxo22により分解されて活性化因子が完全にエストロゲン受容体から外れ、代わりに抑制化因子が結合する。これによりエストロゲン受容体の活性は完全に消失する。しかし、Fbxo22がないと、抗エストロゲン剤を加えても、AF-1領域を介してエストロゲン受容体と活性化因子が結合したままとなり、エストロゲン受容体の活性は保たれる。このため、Fbxo22が欠失した細胞では、抗エストロゲン剤を投与してもエストロゲン受容体活性が高いままとなり、がん細胞の増殖が促進することがわかった。
また、マウスにFbxo22欠損乳がん細胞を移植したところ、抗エストロゲン剤に反応せず増殖し続けることが判明。さらに、乳がん患者の生検検体や病理検体を用いた解析から、エストロゲン受容体陽性/増殖因子受容体陰性のLuminal A乳がんにおいて、細胞内のFbxo22タンパク質の低下が、乳がんの再発や予後と強く相関することがわかった。これまで、Luminal A乳がん患者の高リスク群を選別するマーカーとしてKi-67が用いられていたが、乳がん細胞内のFbxo22タンパク質の解析は、Luminal A乳がん患者の高リスク群を選び出すためのマーカーとして、Ki-67を含めた既知のマーカーよりもすぐれていることが示された。これらの結果は、異なる施設での臨床研究でも確認されたという。
研究グループは今後、「開発したFbxo22に対するモノクロナール抗体を用いた乳がん生検検体の免疫染色法による診断法を確立し、Luminal A乳がんの高リスク群患者をより適格に鑑別することで、手術前後の抗がん剤療法や抗エストロゲン療法を適切に行うための臨床応用に繋げることが第一の目標とし、今回明らかになったメカニズムを標的にした治療薬の開発も行っていく」と述べている。
▼関連リンク
・東京大学医科学研究所 プレスリリース



