BRCAmの新たに進行卵巣がんと診断された患者に対する維持療法
英アストラゼネカ社と米メルク社は10月21日、プラチナ製剤を含む標準的な化学療法による初回治療後に完全奏効または部分奏効を示しているBRCA遺伝子変異陽性(BRCAm)の新たに進行卵巣がんと診断された患者に対する維持治療としての「リムパーザ錠」(一般名:オラパリブ)の第3相SOLO-1試験の詳細結果を発表した。同試験結果は、ESMO2018(欧州臨床腫瘍学会)のプレジデンシャルシンポジウムで発表され、New England Journal of Medicine(NEJM)で掲載された。
画像はリリースより
リムパーザは、ファーストインクラスのポリアデノシン5’二リン酸リボースポリメラーゼ(PARP)阻害剤であり、DNA損傷応答(DDR)経路に異常をきたしたがん細胞に特異的に作用し、細胞死を誘導する治療薬。とくに、複数のin vitro試験により、リムパーザによる細胞毒性はPARP酵素活性の阻害およびPARP-DNA複合体の生成を増加させる可能性があり、その結果DNA損傷およびがん細胞死が生じることが示されている。
SOLO-1試験は、BRCAmの新たに進行卵巣がんと診断された患者を対象としたリムパーザ錠(300mg1日2回)のプラチナ製剤を含む化学療法後の維持療法としての有効性および安全性をプラセボと比較評価することを目的とした無作為化二重盲検プラセボ対照多施設共同第3相試験。同試験は、プラチナ製剤ベースの化学療法による前治療を受け、完全奏効または部分奏効を示している病的変異あるいは病的変異疑いに分類されるBRCA1またはBRCA2遺伝子変異が確認されている391例の患者を無作為に割り付けた。患者は、リムパーザ投与群あるいはプラセボ投与群に無作為に2:1で割り付けられ、最長2年間あるいは病勢進行の時点まで(治験医師の判断による)治療薬の投与を受けた。同試験の主要評価項目は無増悪生存期間(PFS)で、主な副次的評価項目は2次進行もしくは死亡までの期間および最初の後治療開始までの期間、全生存期間を含む。
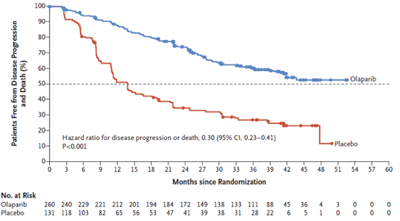
41か月後時点のPFS中央値、リムパーザ投与群では未到達
試験の結果、リムパーザ投与群はプラセボ投与群との比較で、病勢進行あるいは死亡リスクを70%低減させ(ハザード比0.30[95%信頼区間0.23-0.41]、p<0.001)、統計学的に有意かつ臨床的に有意義なPFSの延長を示したという。無作為割付けから41か月後の時点で、プラセボ投与群の患者のPFS中央値は13.8か月に対し、リムパーザ投与群の患者では未到達(Kaplan-Meier曲線が50%を下回っていない)だった。36か月後の時点でリムパーザ投与群の患者のうち60%、プラセボ投与群の27%に病勢進行は見られなかったという。同試験における安全性プロファイルは、過去の臨床試験に見られた結果と一貫していたとしている。
アストラゼネカとMSDは、現在実施しているGINECO/ENGOTov25第3相試験であるPAOLA-1試験を含む卵巣がんの追加試験を追求している。PAOLA-1試験ではBRCA遺伝子変異の有無を問わず、新たに進行卵巣がんと診断された患者の初回治療後の維持療法としてリムパーザとベバシズマブの併用療法を検討している。同試験結果は、2019年下半期に得られる予定だとしている。
▼関連リンク
・アストラゼネカ株式会社 プレスリリース



