男性不妊の原因、多くは精子形成障害
京都大学は10月15日、精巣内のセルトリ細胞表層にある細胞骨格アクチンの網目状構造によって、正常な精子の形態が形成されるという分子メカニズムを解明したと発表した。この研究は、同大大学院医学研究科創薬医学講座の坂本智子特定研究員(現:iPS細胞研究所特定研究員)、タムケオ・ディーン同特定准教授、成宮周同特任教授らの研究グループによるもの。研究成果は「PLOS Biolog」に掲載されている。
画像はリリースより
妊娠を望むカップルのうち約10~15%が不妊であり、その約半数は男性側に原因があると考えられている。男性不妊の原因の多くは精子形成障害だが、その半数は原因不明で、根本的な治療法はない。
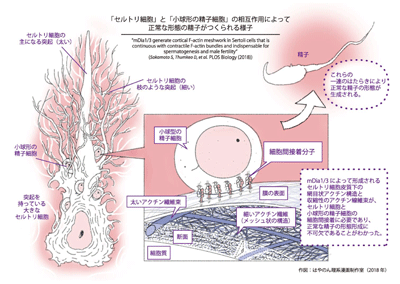
これまでの研究報告では、正常な精子の形成には精子細胞と精巣内に存在している支持細胞であるセルトリ細胞の密接な相互作用が重要であることがわかっている。その際、形成される精子細胞~セルトリ細胞間接着は、細胞間接着分子と裏打ちの細胞骨格アクチンから構成されているが、生体内においてこの裏打ちアクチンがどのような構造をしているのか、そして、どのように形成・維持されるのかについてはほとんどわかっていなかった。
また、細胞骨格アクチンの重合促進分子であるmDiaは、ヒトにおいてmDia1、2、3の3つのアイソフォームが存在しているが、生体内におけるその機能は不明だった。そこで、研究グループはmDia1/3のアクチン重合活性によって形成されるアクチン構造を明らかにし、雄性不妊との関連を解明することを目的に研究を行った。
mDia1/3欠損細胞、速い重合速度のアクチン繊維だけ消失
研究グループは、mDia1/3が主にセルトリ細胞に発現していることから、精原細胞移植実験を行い、精子細胞側ではなく、セルトリ細胞内のmDia1/3欠損が精子形成不全の原因であることを確認。超解像度顕微鏡を用いて、初代培養セルトリ細胞のアクチン線維をナノメートル単位の解像度で観察した。その結果、セルトリ細胞膜直下にメッシュの孔のサイズが約100ナノメートルの網目状アクチンの構造が存在し、このアクチン構造は、mDia1/3の二重欠損や薬剤によるmDiaの不活性化により破綻することがわかった。
次に、網目状アクチンの動態を観察するため、初代培養セルトリ細胞内のアクチン線維を蛍光標識し、スピニングディスク共焦点顕微鏡で高速ライブイメージングを行った。その結果、網目状アクチン構造を構成するアクチン繊維の重合速度には、平均0.4μm/sと1.3μm/sの2種類が混在し、mDia1/3欠損細胞では速い重合速度を示すアクチン繊維だけが消失していることがわかったという。
また、超解像度顕微鏡を用いた解析により、初代培養セルトリ細胞においてmDia依存的な網目状アクチン構造を構成するアクチン繊維は、収縮性のあるアクトミオシン線維束とつながっていることを発見。さらに、mDia1/3二重欠損セルトリ細胞ではアクトミオシン線維束が有意に減少し、収縮性のないEspin結合アクチン線維束が増加していたという。その後に行った評価でも、mDia1/3 二重欠損セルトリ細胞は、精子細胞と正常な細胞間接着をほとんど形成していないことが判明。これらの結果から、mDia1/3 二重欠損は、収縮性アクトミオシン線維束の減少と非収縮性の Espin 結合性アクチン線維の増加をきたし、セルトリ細胞~精子細胞の接着形成・維持に障害をきたすと考えられるという。
今回の研究成果は、セルトリ細胞内のアクチン細胞骨格系の異常が男性不妊の原因のひとつになりうることを示唆している。研究グループは、「雄性不妊の原因の一端を解明した本研究は、一部の男性不妊の新しい治療法開発の糸口になる可能性が期待される」と述べている。
▼関連リンク
・京都大学 研究成果



