既存の候補化合物の構造式で新たな候補化合物を探索・設計
富士フイルム株式会社は10月4日、世界で初めて、医薬品候補化合物の構造式から新たな候補化合物を自動的に探索し、設計できる医薬品候補化合物探索・設計シミュレーション技術(AI-AAM)を開発したと発表した。
画像はリリースより
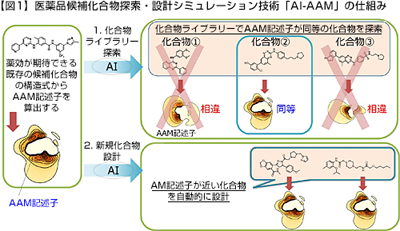
今回開発したAI-AAMは、タンパク質の構成要素である20種のアミノ酸と化合物の結合力を数値化することでタンパク質と化合物の結合力を予測できる独自の「アミノ酸マッピング(Amino-Acid Mapping, AAM)記述子」と、安定した構造を持つ化合物を新規設計する独自AI技術を組み合わせて、既存の医薬品候補化合物の構造式だけで新たな候補化合物を自動的に探索・設計できるシミュレーション技術。AI-AAMは、既存の医薬品候補化合物の構造式から算出した「AAM記述子」をもとに、標的タンパク質との結合力がその化合物と同等で骨格が異なる新たな化合物を自動的に探索・設計することが可能だという。
この手法は、結果から原因を推定する逆問題解法を採用しているため、化合物ライブラリーから骨格の異なる化合物を探索するだけではなく、従来発想できなかった骨格を持つ化合物を新たに設計することができる。さらに、疾患ごとに異なる標的タンパク質の立体構造やAIに学ばせる膨大な実験データが不要で、既存の医薬品候補化合物の構造式にAI-AAMを適用するだけで、新たな化合物を探索・設計できるため、高い利便性と汎用性を実現している。
ひとつの抗がん剤候補化合物から33個の新規化合物を設計
今回同社はAI-AAMを用いて、化合物ライブラリーから、抗がん剤や抗菌剤の候補化合物が持つ「AAM記述子」と同等の化合物を探索。その後、合成して標的タンパク質との結合力を評価した結果、抗がん剤では7%、抗菌剤では15%の確率で同等の結合力を持つ化合物を見つけ出した。これは、ハイスループット・スクリーニングによる確率(0.1%未満)を大きく上回り、ドッキング・シミュレーションによる確率(10%未満)も上回る可能性を示すものだという。
また、あるひとつの抗がん剤候補化合物にAI-AAMを適用したところ、標的タンパク質の結合力が同等で骨格が異なる、33個の新規化合物を1週間で設計することに成功。AI-AAMは、タンパク質より分子量が小さいアミノ酸との相互作用を用いた技術であるため、標的タンパク質の立体構造を必要とする手法と比較して、1/1,000以下の計算量となることから、短期間に多くの新規化合物を生み出すことができたという。これらのことにより、AI-AAMは、医薬品候補化合物を探索するのみならず、新たに設計する技術として非常に高い有用性が確認されたとしている。
新薬が発売に至るまでには、基礎研究、非臨床試験、臨床試験、承認申請など、長いプロセスがあり、莫大な費用と時間がかかる。また、基礎研究で探索した医薬品候補化合物が新薬として発売できる確率は、約2~3万分の1といわれており、標的タンパク質との結合力を有する化合物であっても、毒性などの問題で実用化できないケースが多くある。そのため、標的タンパク質との結合力を持ち、骨格が異なる化合物をより多く保有することが新薬開発の成功の鍵となる。同社は「AI-AAMは、これまで必要と考えられていた標的タンパク質の構造の解析などを必要とせずに、候補化合物の構造式だけで新規候補化合物を探索・設計することができるため、新薬開発の期間短縮と成功確率向上に大きく貢献する」としている。
▼関連リンク
・富士フイルム株式会社 ニュースリリース



