明らかにされていなかった小胞媒介性核外輸送の分子機構
東京大学は8月23日、ヘルペスウイルス(HSV)カプシドの核外輸送には、本来細胞質で機能する宿主のESCRT-IIIシステムが利用されていることを明らかにしたと発表した。この研究は、同大医科学研究所の川口寧教授、有井潤助教らの研究グループによるもの。研究成果は「Nature Communication」に掲載されている。
画像はリリースより
HSVはヒトに口唇ヘルペス、脳炎、性器ヘルペス、皮膚疾患、眼疾患、新生児ヘルペスといった多様な病態を引き起こす。HSVは一度感染するとヒト体内に終生潜伏し、潜伏と再発を繰り返すことが特徴で、実に人類の70%以上がHSVの感染者とされている。
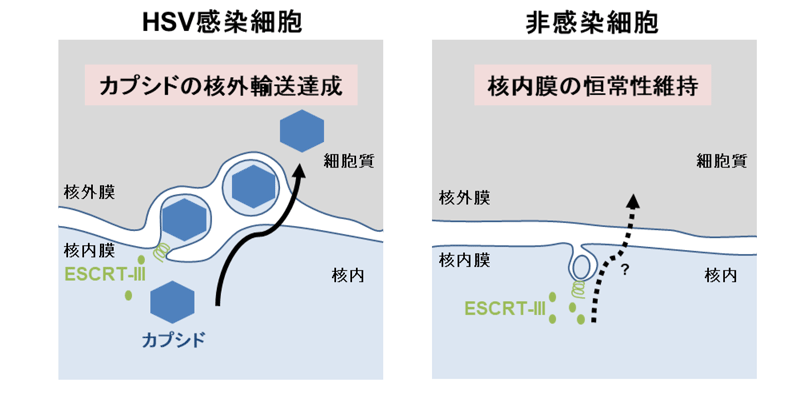
DNAウイルスであるHSVは、核内においてウイルスゲノムを内包したカプシドを形成するが、増殖するためには、最終的にウイルス粒子が形成される細胞質へと輸送される必要がある。しかし、巨大な複合体であるHSVカプシドは、核膜孔の通過許容サイズを超えているため、小胞媒介性核外輸送という細胞生物学上ユニークな核外輸送機構で核内から細胞質へ輸送される。また、ウイルスが感染していないハエの細胞において、巨大リボ核タンパク質(RNP)複合体が類似した方法で核外輸送されることがわかっていたが、その分子機構は不明だった。
HSV感染症の新しい治療法や予防法の開発へ期待
細胞に本来備わっているESCRT-IIIシステムは、細胞質で機能し、多くのウイルスの出芽や細胞外小胞の形成の最終段階において細胞質膜を切断する。今回の研究では、HSVを感染させた細胞において、ESCRT-IIIはHSVタンパク質UL31/UL34依存的に核内膜に集積されていることが判明。ESCRT-IIIを阻害すると、核内膜からのHSVの出芽を抑制し、ウイルスの増殖が著しく阻害されたという。この結果から、HSVは自身のウイルス因子を利用して、ESCRT-IIIシステムという宿主細胞機構を核内膜において活性化することでHSVカプシドの核外輸送を達成していることが明らかになった。
また、ESCRT-IIIの阻害は、ハエ細胞における巨大RNP複合体の核外輸送も阻害。さらに、HSVが感染していないヒト細胞においてESCRT-IIIを阻害すると、核内膜の過形成が誘導され、これまで細胞質膜の切断を担うとされてきたESCRT-IIIは、非感染細胞においても核内膜で機能し、RNPの核外輸送や核内膜の恒常性維持に貢献していることが明らかになったという。
小胞性核外輸送は、ほとんどの非感染培養細胞で検出できないため、長らくこの現象はヘルペスウイルス感染細胞特有の現象だと考えられてきた。今回の研究では、ウイルス研究から、細胞に本来備わっているユニークな核外輸送の分子機構とその意義を明らかになった。この分子機構の解明は、HSV感染症の新しい治療法や予防法の開発に繋がることが期待されると同時に、病態発現機構の解明と治療法開発への一歩となることが考えられる、と研究グループは述べている。
▼関連リンク
・東京大学 UTokyo Focus




