タンパク質の結晶化を妨げるアミノ酸残基「リジン」
理化学研究所は、タンパク質を生化学的手法で分析することにより、結晶化を妨げている部位を実験的に特定する新技術を開発したと発表した。この研究成果は、理研放射光科学研究センター理研RSC-リガク連携センターの国島直樹客員研究員らの共同研究グループによるもの。研究は、国際科学雑誌「Analytical Biochemistry」オンライン版に7月17日付けで掲載されている。
画像はリリースより
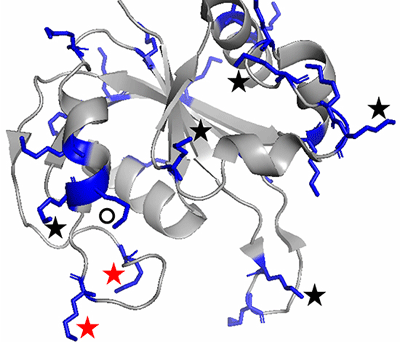
構造生物学研究のためには、タンパク質を結晶化して構造解析する手法が一般的だが、タンパク質の結晶化は容易ではない。タンパク質の分子表面に存在するリジンというアミノ酸残基は結晶化を妨げることが知られており、分子表面リジン残基を実験的に検出する方法があれば、それを他のアミノ酸に置換することで、タンパク質結晶を得る確率を高めることができる。
分子表面リジン残基を市販の試薬で化学修飾
今回、共同研究グループは、分子表面リジン残基をNHS-ビオチンという市販の試薬で化学修飾し、修飾を受けたリジン残基を一般的な質量分析法であるMALDI-TOF MSで特定する方法を提案。タンパク質分子の他の残基と相互作用しているリジン残基は、この修飾を受けにくいと考えられるという。この方法自体は特に新しいものではないが、タンパク質結晶化を目的としている点に新奇性があるとしている。実験手順は非常に簡便であり、結晶化に使う程度の量の精製タンパク質試料とタンパク質化学の一般的な研究設備があれば、2日で行うことができるという。
この技術の有効性を、PH1033というモデルタンパク質で確かめたところ、タンパク質結晶の合理設計のターゲットとなるリジン残基を、全リジン残基の3割程度に絞り込めることが判明。この3割をターゲットに合理設計技術を適用すれば、効率的に結晶を得ることができると考えられる。
今後、この技術を広く適用することで解析可能なタンパク質が増加し、創薬応用を含む構造生物学の発展と将来の医療問題の解決につながる、と研究グループは述べている。
▼関連リンク
・理化学研究所 プレスリリース



