iPS細胞由来ドパミン神経前駆細胞移植の安全性と有効性を検討
京都大学医学部附属病院は7月30日、同大iPS細胞研究所と連携し計画してきた「iPS細胞由来ドパミン神経前駆細胞を用いたパーキンソン病治療に関する医師主導治験」を年8月1日より開始すると発表した。
画像はリリースより
この計画は、「パーキンソン病に対するヒトiPS細胞由来ドパミン神経前駆細胞の細胞移植による安全性及び有効性を検討する医師主導治験(第1/2相)」、「パーキンソン病に対するヒトiPS細胞由来ドパミン神経前駆細胞の細胞移植時におけるタクロリムスの安全性及び有効性を検討する医師主導治験(第3相)」の2つの治験からなり、同一の患者が参加する。第1/2相ではヒトiPS細胞由来ドパミン神経前駆細胞を線条体に移植することによる安全性および有効性を評価、第3相ではヒトiPS細胞由来ドパミン神経前駆細胞を線条体に移植した被験者に対するタクロリムスの安全性および有効性の評価を行うという。
実施予定人数は7人、観察期間は移植後2年間
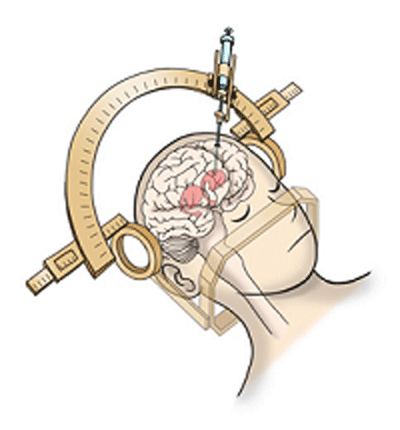
この治験では、iPS細胞から分化誘導したドパミン神経前駆細胞(計約500万個)を患者の脳の線条体部分(左右両側)に移植する。移植する細胞は、京大iPS細胞研究所で構築している「再生医療用iPS細胞ストック」から提供されたiPS細胞をドパミン神経前駆細胞へ分化させたもの。頭部を固定した上で頭蓋骨に直径12mmの穴を開け、そこから注射針のような器具で細胞を注入する。また、細胞移植後に免疫反応が起こる可能性があるため、すでに臓器移植などで臨床実績のあるタクロリムスを細胞移植時の免疫抑制剤として使用する。実施予定人数は7人、観察期間は移植後2年間(1人あたり)。
主な適格基準は、選択基準として、パーキンソン病であること、既存の薬物治療では症状のコントロールが十分に得られていないこと、同意取得時の年齢が50才以上70才未満であること、罹病期間が5年以上であること、オフ時のHoehn&Yahr重症度分類がstage3以上であること、オン時のHoehn&Yahr重症度分類がstage3以下であること、L-ドパ反応性が30%以上であることなど。除外基準としては、頭部MRI において症候性の器質的病変が認められること、免疫機能異常があること、認知症または認知症のリスクが高いと判断されること、出血傾向または凝固機能異常があることなどがあげられている。
なお、参加患者の募集については、同大医学部附属病院ホームページ内に特設ぺージ(9月末までの期間限定)が作成されている。




