宿主タンパク質の発現抑制に重要な役割を果たすPA-X
東京大学は7月25日、インフルエンザウイルスのタンパク質「PA-X」による宿主タンパク質の発現抑制にN末端アセチル化酵素複合体「NatB」が重要な働きをすることを突き止め、NatBによるPA-XのN末端アセチル化がPA-Xの抑制活性に重要であることを明らかにしたと発表した。この研究は、同大医科学研究所の河岡義裕教授のグループによるもの。研究成果は「Cell Reports」に掲載されている。
画像はリリースより
インフルエンザウイルスが細胞に感染すると、感染した細胞においてタンパク質の発現が抑制される。これにより生体がウイルスを排除しようとする反応が抑えられ、インフルエンザウイルスが効率よく増殖できるようになる。これまでにインフルエンザウイルスのPA-Xが、この宿主タンパク質の発現抑制に重要な役割を果たすことはわかっていたが、PA-Xによる宿主タンパク質の発現抑制に宿主タンパク質が関与するかどうかなどの分子メカニズムは、明らかにされていなかった。
NatBよるPA-XのN末端のアセチル化が重要
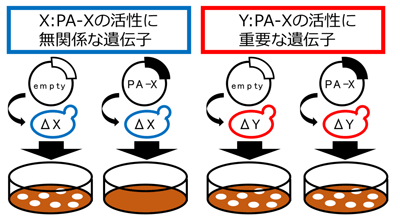
研究グループは、PA-Xの活性に重要な宿主のタンパク質を同定するため、一遺伝子欠損酵母ライブラリーを用いたスクリーニングを実施。その結果、PA-Xのタンパク質発現を抑制する活性に必須な遺伝子として、Nat3とMdm20を同定した。
遺伝子Nat3とMdm20は、それぞれNat3pとMdm20pというタンパク質をコードしている。これらのタンパク質は二量体を形成し、タンパク質複合体NatBとして働くことが知られている。NatBはタンパク質の特定のN末端配列を認識し、そのN末端をアセチル化する。そこで、ヒト細胞におけるPA-Xの活性にもNatBが重要かどうかを調べるため、NatBを欠損したヒト細胞を作製。すると、NatBを欠損したヒト細胞ではPA-Xは、低い活性しか示さないことがわかったという。また、通常のヒト細胞で発現させたPA-Xは、高頻度でそのN末端がアセチル化されていたのに対し、NatBを欠損したヒト細胞で発現させたPA-Xは、N末端アセチル化を受けている割合が低下していることも判明した。これらのことから、NatBはPA-Xのタンパク質発現を抑制する活性およびPA-XのN末端アセチル化に重要であることが示された。さらに、変異体PA-Xを用いた解析を行った結果、N末端にNatB認識配列をもつ変異体PA-Xが高い活性を持つことがわかった。以上の結果から、NatBによってPA-XのN末端がアセチル化されることが、PA-Xのタンパク質発現を抑制する活性に重要であることが明らかとなったとしている。
インフルエンザウイルス以外の多くのウイルスでも、宿主タンパク質の発現を抑制するウイルスタンパク質の存在が報告されている。今回の研究で得られた知見は、インフルエンザのみならず他のウイルス感染症を理解し、制御する手がかりとなることが期待される、と研究グループは述べている。
▼関連リンク
・東京大学 UTokyo FOCUS



