腸内細菌の構成や分布調節に重要な役割を果たすIgA
理化学研究所は7月24日、免疫グロブリンA(IgA)が腸内細菌叢を制御するための新たなメカニズムを明らかにしたと発表した。この研究は、理研生命医科学研究センター粘膜免疫研究チームの鈴木敬一朗上級研究員、シドニア・ファガラサンチームリーダーらの国際共同研究グループによるもの。研究成果は、米科学雑誌「Journal of Experimental Medicine」オンライン版に掲載されている。
画像はリリースより
人間の体内に1,000種類以上存在する腸内細菌は、粘膜バリアーの構築、免疫組織の成熟、全身の代謝調節などに必須の役割を担っている。腸管内に多量に分泌されるIgA抗体は、腸内細菌の構成や分布の調節に重要な役割を果たすことが知られているが、IgAがどのようなメカニズムで腸内細菌の調節に関わっているのかは未解明だった。
粘液関連機能因子に炎症性腸疾患の発症を予防する機能
これまでの研究により、IgAは腸内で常在細菌の表面をコートしていることが知られていた。また、このコーティングには、通常の抗体-病原菌の結合様式とは異なり、糖鎖を介する場合があることが指摘されている。そこで、研究チームは細菌成分を認識しない単クローンIgA(7-6IgA)を作製し、強い糖鎖修飾を受けたIgAと細菌間の相互作用を詳しく解析した。
その結果、卵白を構成する主要なタンパク質であるオボアルブミン(OVA)を認識する7-6IgAが、ヒトの主要な腸内細菌であるBacteroides thetaiotaomicron(B.theta)と糖鎖を介して結合することを発見。また、7-6IgAは大腸粘液の中でB.thetaの機能未知遺伝子の発現を誘導することもわかり、この遺伝子由来のタンパク質を「粘液関連機能因子(Mucus-Associated Functional Factor;MAFF)」と名付けて詳しく解析した。
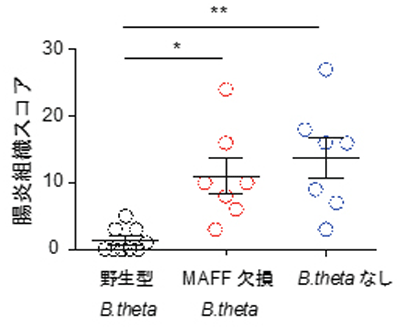
すると、B.thetaはMAFFの働きを介して、Firmicutes門に属する他の細菌種と相互作用し、腸内細菌叢全体の構成や代謝機能を変化させることが判明。さらに、マウスの腸炎モデルを用いた実験では、B.thetaを定着させなかったマウスとMAFFオペロンを欠損したB.theta株を定着させたマウスが激しい腸炎を発症したのに対し、野生型のB.thetaを定着させたマウスでは腸炎発症に強い抵抗性を示した。これにより、MAFFが炎症性腸疾患の発症を予防する機能を持つことが明らかになったという。
今回の研究により、これまで知られていなかったIgAの働きが明らかとなった。しかし、この過程には腸内細菌の粘液内への局在に加え、異なる細菌種との相互作用が関与しているため、いまだ疑問点が多く残されている。今後は、MAFFがどのような分子を認識して細菌間の相互作用を発揮するのかなどが、解明すべき重要な項目となる。これらの研究を積み重ねることが、炎症性腸疾患の新たな予防法・治療法の開発に繋がるものと期待される。
▼関連リンク
・理化学研究所 プレスリリース




